Hydratacja
Gdy chlorek sodu rozpuszcza się w wodzie, jony sodu i chlorku oraz polarne cząsteczki wody są silnie przyciągane do siebie przez oddziaływania jonowo-dipolowe. Cząsteczki rozpuszczalnika (w tym przypadku wody) otaczają jony usuwając je z kryształu i tworząc roztwór. W miarę postępu procesu rozpuszczania poszczególne jony są usuwane z powierzchni ciała stałego, stając się całkowicie odrębnymi, uwodnionymi gatunkami w roztworze.
Rozpuszczanie NaCl w wodzie
Twoja przeglądarka nie obsługuje tagu video
Aby rozpuścić chlorek sodu w wodzie, muszą zajść trzy procesy:
- molekuły wody muszą zostać rozdzielone (wiązania H muszą zostać przerwane)
- siły przyciągania między jonami w sieci NaCl muszą zostać przerwane
- muszą powstać oddziaływania rozpuszczalnik-roztwór(jon-dipol)
Ogólna zmiana entalpii przy tworzeniu roztworu jest sumą zmian energii dla każdego z tych procesów.
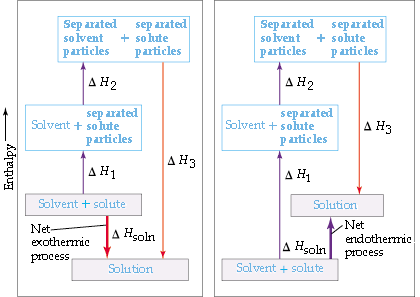
To, czy proces rozpuszczania będzie egzotermiczny czy endotermiczny, zależy od względnych wielkości zmian energii dla trzech etapów. Ogólnie rzecz biorąc, substancja będzie nierozpuszczalna, jeśli energia wydatkowana na rozerwanie cząsteczek rozpuszczalnika i solutu jest znacznie większa niż energia wydzielana podczas nawiązywania interakcji rozpuszczalnik-rozpuszczalnik.
Energia hydratacji
Gdybyś wziął gazowe kationy i włożył je do wody, utworzyłyby one uwodnione jony i uwolniłyby duże ilości energii. Energia ta nazywana jest energią hydratacji kationu. Chociaż jest to eksperyment niemożliwy do wykonania, energie hydratacji zostały wyznaczone pośrednio (zobaczysz, jak to się robi w dalszej części semestru).

.
- Korzystając z danych zawartych w tabeli Energie hydratacji, wyjaśnij tendencje zmian entalpii hydratacji w zależności od promienia jonowego.

- Rozważ pierwiastki o podobnym ładunku i promieniu, które mają różną elektronegatywność.
- porównaj Rb+1 i Tl+1
- porównaj Sr+2 i Pb+2
- porównaj Lu+3 i Tl+3
Zaproponuj wyjaśnienie zaobserwowanej tendencji.
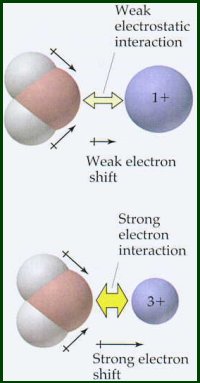
Jak można się spodziewać na podstawie prawa Coulomba
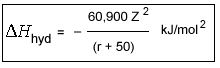 Równanie Latimera
Równanie Latimera W tym równaniu Z jest ładunkiem na kationie, a r jest promieniem kationu (w pm). Stała, 50, jest w przybliżeniu równa promieniowi atomu tlenu w wodzie.
Równanie Latimera nie obejmuje skutków elektroujemności. Równanie to jest ważne dla kationów, które mają elektroujemność mniejszą niż 1,5. Porównaj dane dotyczące energii hydratacji dla kationów o elektroujemności 1.5. Kationy o elektronegatywności >1.5 mają znacznie wyższe energie hydratacji niż bardziej elektropozytywne kationy o porównywalnym promieniu i ładunku. Te elektronegatywne metale mają pewien stopień wiązania kowalencyjnego w ich interakcji z atomem tlenu w cząsteczce wody, to znaczy, że niepodzielona para elektronów tlenu jest dzielona z atomem metalu.
Hydroliza
Jony metali w roztworze wodnym zachowują się jak kwasy Lewisa. Dodatni ładunek na jonie metalu wyciąga gęstość elektronów z wiązania O-H w wodzie. To zwiększa polaryzację wiązania, ułatwiając jego zerwanie. Kiedy wiązanie O-H pęka, wodny proton jest uwalniany, tworząc kwaśny roztwór.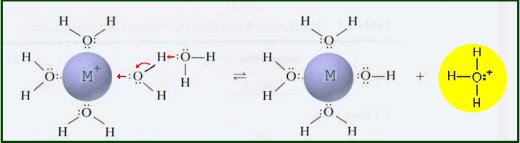
Stała równowagi dla tej reakcji może być zmierzona.
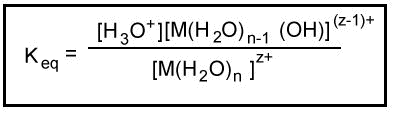
Zauważ podobieństwo równania hydrolizy uwodnionego kationu z równaniem jonizacji słabego kwasu w roztworze wodnym.
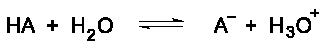

Keq dla hydrolizy uwodnionego kationu jest analogiczne do Ka dla jonizacji słabego kwasu. Keq jest stałą jonizacji kwasu.Ogólnie, stałe hydrolizy dla kationów są tabelaryczne jako -log Ka. Te tabelaryczne stałe hydrolizy są średnimi z różnych pomiarów eksperymentalnych, które czasami różnią się o więcej niż jedną jednostkę pKa. Z tego powodu, małe różnice nie są uważane za znaczące przy porównywaniu wartości tych stałych.

| |
||||||||||||||||||
Weź dane z Tabeli stałych hydrolizy dla kationów metali do tych pytań.
|