Pronounced „ZEE-non,” ten element jest gazem używanym głównie w lekkiej produkcji. Ksenon jest jednym z gazów obojętnych lub szlachetnych, jest bezwonny, bezbarwny, bez smaku i chemicznie niereaktywny. Chociaż sam w sobie nie jest toksyczny, jego związki są silnymi utleniaczami, które są wysoce toksyczne.
Tylko fakty
Według Jefferson National Linear Accelerator Laboratory, właściwości helu są następujące:
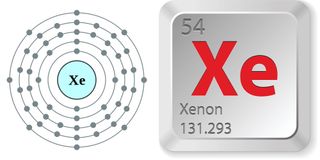
- Liczba atomowa: 54
- Masa atomowa: 131.293
- Punkt wrzenia: 165,03 K (-108,12°C lub -162,62°F)
- Punkt topnienia: 161,36 K (-111,79°C lub -169,22°F)
- Faza w temperaturze pokojowej: Gaz
- Gęstość: 0.005887 gramów na centymetr sześcienny
- Klasyfikacja pierwiastków: Niemetal
- Numer okresu: 5
- Numer grupy: 18
- Nazwa grupy: Gaz szlachetny
Historia
Ksenon został odkryty przez szkockiego chemika Williama Ramsaya i angielskiego chemika Morrisa Traversa w lipcu 1898 roku w University College London. Nie było to ich pierwsze odkrycie. Już wcześniej para ta ekstrahowała argon, neon i krypton z ciekłego powietrza.
Odkrycie to nastąpiło, gdy bogaty przemysłowiec, Ludwig Mond, podarował zespołowi nową maszynę do produkcji ciekłego powietrza. Dzięki nowej maszynie wyekstrahowali oni więcej kryptonu z ciekłego powietrza. Następnie wielokrotnie destylowali krypton i wyizolowali cięższy gaz. Ramsay i Travers zbadali ten cięższy gaz w rurze próżniowej i zauważyli, że emituje on piękną niebieską poświatę. Zaklasyfikowali nowy gaz jako obojętny i nazwali go ksenonem, pochodzącym od greckiego „xenos”, co oznacza obcy.
Jednakże w 1962 roku Neil Bartlett udowodnił, że ksenon nie był w rzeczywistości gazem obojętnym. Mógł wywoływać reakcje i związki. Udowodnił to, tworząc pochodną fluoru. Od tego czasu powstało ponad 100 związków ksenonu, jak podaje Royal Society of Chemistry.
Naturalny ksenon ma dziewięć stabilnych izotopów i 20 izotopów niestabilnych. Niektóre związki, które mogą być tworzone z ksenonem to difluorek, deuteran ksenonu, trójtlenek ksenonu, nadtlenek sodu, hydrat ksenonu, tetrafluorek i heksafluorek. Innym ciekawym związkiem jest metaliczny ksenon powstały w wyniku zastosowania ogromnego ciśnienia.
Źródła
Ksenon jest gazem śladowym występującym w atmosferze ziemskiej w ilości około jednej części na 20 milionów, według Los Alamos National Laboratory. To czyni go bardzo rzadkim. Występuje również w atmosferze Marsa w ilości 0,08 ppm.
Ten gaz szlachetny można również znaleźć na Ziemi. Niektóre źródła mineralne emitują ksenon. Firmy pozyskują ten gaz do celów komercyjnych z zakładów przemysłowych, które wydobywają go z ciekłego powietrza.
Ksenon może występować również w Ziemi. Przez długi czas naukowcy podejrzewali, że 90 procent więcej tego gazu powinno znajdować się w atmosferze Ziemi, na podstawie ich wiedzy o innych gazach szlachetnych. „Brakujący ksenon paradoks jest długoletnie pytanie,” powiedział Yanming Ma, fizyk obliczeniowy i chemik na Uniwersytecie Jilin w Changchun, Chiny. .
W końcu naukowcy, w tym Ma, znaleźli dowody na to, że brakujący gaz może znajdować się w jądrze Ziemi. Ekstremalne temperatury i ciśnienia występujące w jądrze Ziemi mogą powodować wiązanie się ksenonu z żelazem i niklem znajdującymi się w jądrze, magazynując tam gaz. „Mamy nadzieję, że przyszłe wysokociśnieniowe eksperymenty mogą zostać przeprowadzone w celu potwierdzenia naszych przewidywań,” powiedział Ma.
Użycia
Ksenon tworzy niebieską lub lawendową poświatę, gdy jest poddawany wyładowaniom elektrycznym. Lampy wykorzystujące ksenon oświetlają lepiej niż konwencjonalne światła. Na przykład, lampy stroboskopowe, fotograficzne lampy błyskowe, wysokowydajne lampy łukowe do projekcji filmów, niektóre lampy używane do obserwacji głębinowych, lampy bakteriobójcze, lampy do łóżek słonecznych i łuk wysokociśnieniowy – wszystkie one używają tego gazu. W rzeczywistości, prawdopodobnie widzisz lampy ksenonowe na co dzień. Niektóre reflektory samochodowe wykorzystują ksenon. Jeśli widzisz reflektory, które emitują delikatną niebieską poświatę, prawdopodobnie są one wykonane z ksenonu.
Gaz ten ma również inne zastosowania. Jest używany w elektrowniach jądrowych oraz do wypełniania lamp telewizyjnych i radiowych. Krzemowe mikroprocesory są wytrawiane za pomocą difluorku ksenonu. Napędy jonowe ksenonu utrzymują niektóre satelity i inne statki kosmiczne na orbicie. Ksenon jest nawet wykorzystywany do produkcji leku o nazwie 5-fluorouracil, który jest stosowany w leczeniu niektórych rodzajów raka, jak podaje Royal Society of Chemistry.
Bieżące badania
Istnieje kilka badań, które koncentrują się na ksenonie. Projekt Xenon Dark Matter Project, na przykład, eksperymentuje z detektorem ciekłego ksenonu w celu poszukiwania ciemnej materii. Ciemna materia jest opisywana jako niewidzialny klej, który trzyma wszechświat razem. W tym eksperymencie, ciekły ksenon jest umieszczany w komorze projekcji czasowej. Kiedy cząsteczki w komorze zachowują się w sposób, w jaki nie powinny, może to być oznaką oddziaływania ciemnej materii z cząsteczkami.
Kooperacja Large Underground Xenon (LUX) jest kolejnym, podobnym eksperymentem. Ten detektor ciemnej materii również wykorzystuje ciekły ksenon. Choć projekt nie przyniósł żadnych rezultatów, badania zmieniły koncepcje dotyczące ciemnej materii.
Kto wiedział?
- Radioaktywny jod-131 może rozpadać się na stabilny ksenon, tak jak to miało miejsce w Fukushimie.
- Ksenon nie jest jedynym gazem szlachetnym. Neon, argon, krypton, hel i radon są również gazami szlachetnymi.
- Jak hel, można wypełnić balony ksenonem, ale jest to bardzo drogie i balon staje się bardzo ciężki, ponieważ gaz jest tak gęsty. Przeciętny balon może pomieścić około 40 funtów. (18,1 kg) ksenonu, zgodnie z eksperymentem przeprowadzonym przez Royal Society of Chemistry.
- Atomy ksenonu dodane do ciekłego helu są używane do obserwacji kwantowych tornad.
.