Dlaczego atomy wiążą się ze sobą?
Atomy wiążą się ze sobą, aby obniżyć swoją energię i stać się stabilnymi. A kiedy atomy łączą się z innymi atomami, często tworzą cząsteczki o unikalnych właściwościach chemicznych i fizycznych. Użyjmy poniższego modelu, aby wyjaśnić, jak atomy wiążą się, aby stać się stabilnymi.
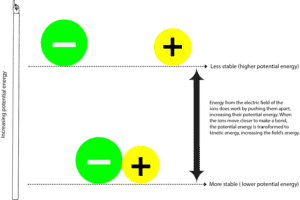
Gdy ujemnie naładowany atom (anion) i dodatnio naładowany atom (kation) tworzą wiązanie, są one zazwyczaj bardziej stabilne z niższą energią potencjalną. Energia potencjalna to energia wynikająca z relatywnego położenia tych jonów w otaczającym je polu elektrycznym. Pole elektryczne to obszar, w którym działa siła. Pod pewnymi względami pole elektryczne jest podobne do pola magnetycznego. I można zobaczyć te linie sił otaczających magnetyczny, gdy rozprzestrzeniają się opiłki żelaza wokół niego.
Aby oddzielić jon ujemny od jonu dodatniego, pole elektryczne otaczające jony musi wykonać pracę poprzez pociągnięcie tych jonów od siebie. Jak pole elektryczne to zrobić, to również przekazuje energię do tych cząstek, zwiększając ich energię potencjalną. Możesz porównać ten proces do ciągnięcia dwóch magnesów, które się przyciągają. W tym przypadku to ty jesteś polem siłowym dostarczającym energii, aby odciągnąć je od siebie, a gdy je odciągasz, magnesy zwiększają swoją energię potencjalną. A ponieważ muszą wykonać więcej pracy, aby utrzymać się z dala od siebie, stają się niestabilne. Jak tylko puścisz magnes, dwa magnesy szybko przyciągają się do siebie, obniżając swoją energię potencjalną. Teraz,
gdzie podziała się reszta energii potencjalnej?
Ta energia została przekazana z powrotem do ciebie i otoczenia w postaci energii kinetycznej. Energia kinetyczna jest energią, którą posiada obiekt, gdy się porusza, a my często odczuwamy tę energię jako ciepło. Więc za każdym razem, gdy odczuwasz ciepło, oznacza to, że energia przemieszcza się z gorętszego miejsca do zimniejszego. Lub inaczej mówiąc, z bardziej skoncentrowanego do mniej skoncentrowanego źródła. Należy pamiętać, że energia nigdy nie może być przekazywana w drugą stronę – z zimniejszego do gorętszego miejsca.
Więc, gdy energia jest przekazywana z i z powrotem do pola lub z i z powrotem do wszechświata, zwykle mówimy, że energia jest zachowana. Oznacza to, że nie możemy stworzyć ani zniszczyć energii, możemy ją jedynie przekształcić z jednej formy w inną. To jest od energii potencjalnej do kinetycznej i od kinetycznej do potencjalnej.
Co atomy używają do łączenia się z innymi atomami?
Atomy używają swoich elektronów walencyjnych do łączenia się z innymi atomami. Aby atomy mogły się związać, muszą wykonać co najmniej jedną z poniższych czynności:
- zyskać elektrony od innych atomów
- utracić elektrony na rzecz innych atomów
- dzielić się elektronami z innymi atomami
Przypomnij sobie, że elektrony walencyjne zajmują najwyżej położony energetycznie orbital w atomie. I możesz zwizualizować te elektrony kiedy piszesz konfigurację elektronową dla atomu. Jeśli zrobisz to z pierwiastkami grupy głównej z pierwszego i drugiego okresu, zauważysz, że wodór ma jeden elektron walencyjny, azot ma 5, tlen ma 6 a neon ma 8.
Jeśli narysujemy te elektrony walencyjne stawiając kropkę(i) na górze, po prawej, na dole i po lewej stronie ich symboli chemicznych, otrzymamy te proste diagramy zwane diagramami kropkowymi Lewisa, nazwane na cześć Lewisa, który jako pierwszy użył ich do wyjaśnienia idei wiązania. Teraz, omówmy dalej wiązanie z następującymi strukturami Lewisa:
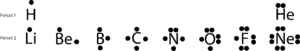
Jeśli spojrzysz na pierwiastki na drugim okresie, zauważysz, że tylko Neon (Ne) ma dwa elektrony na każdej ze swoich czterech stron. Jeśli zsumujesz wszystkie elektrony na wszystkich czterech bokach, odkryjesz, że wokół niego jest osiem elektronów.
Liczba osiem jest związana z ostatnią cyfrą numeru grupy, do której należy Ne, grupy 18. Ta specjalna grupa elementów, zwanych gazami szlachetnymi, mają tendencję do bycia stabilnymi i niereaktywnymi w normalnych warunkach. Z wyjątkiem helu, wszystkie one mają osiem elektronów walencyjnych w grupie.
Ponieważ ich zachowanie chemiczne, Lewis był w stanie wywnioskować, że aby inne elementy osiągnąć stabilną konfigurację jak gazy szlachetne, muszą reagować z innymi atomami, aby to osiągnąć. Na podstawie tego wniosku Lewis zaproponował regułę oktetu. Regułę ośmiu.
Ale są wyjątki, jak można powiedzieć, wodór potrzebuje tylko dwóch elektronów, aby osiągnąć stabilną konfigurację podobną do He. Pomimo tego i innych niedociągnięć, struktury kropkowe Lewisa mogą w prosty sposób wyjaśnić, jak atomy się wiążą, bez konieczności rysowania skomplikowanych orbitali atomowych.
Co powoduje, że atomy wiążą się z innymi atomami?
Energia! Energia jest zazwyczaj siłą napędową wiązania. Aby atomy mogły się wiązać, muszą osiągnąć delikatną równowagę pomiędzy przyciągającymi i odpychającymi siłami swoich jąder i elektronów. Aby dowiedzieć się jak dwa atomy wodoru dzielą się elektronami tworząc cząsteczkę wodoru, kliknij tutaj.