Co to jest spin elektronu?
Spin elektronu jest kwantową własnością elektronów.Jest to forma momentu pędu.Wielkość tego momentu pędu jest stała.Podobnie jak ładunek i masa spoczynkowa, spin jest fundamentalną, niezmienną własnością elektronu.

Jako metodę nauczania, instruktorzy czasami porównują spin elektronu do Ziemi obracającej się wokół własnej osi co 24 godziny.Jeśli elektron obraca się zgodnie z ruchem wskazówek zegara na swojej osi, jest to opisywane jako spin-up; przeciwnie do ruchu wskazówek zegara to spin-down.
Spinowy moment pędu związany ze spinem elektronu jest niezależny od orbitalnego momentu pędu, który jest związany z podróżą elektronu wokół jądra.
Spin elektronu nie jest używany do definiowania powłok elektronowych, podpowłok, orbitali, w przeciwieństwie do liczb kwantowych n, l, i ml.
Spin elektronu a liczba kwantowa spinu elektronu
Spin elektronu i liczba kwantowa spinu elektronu są często traktowane jako jedna i ta sama rzecz.Obie są liczbami kwantowymi.W rzeczywistości są to różne, ale bardzo blisko związane pojęcia.
– spin elektronu ma symbol s
– liczba kwantowa spinu elektronu ma symbol ms.
s
Spin elektronu, s, ma tylko jedną możliwą wartość.Ta wartość to ½.Podobnie jak masa spoczynkowa i ładunek elektronu, spin nie zmienia się.
ms
W przeciwieństwie do masy spoczynkowej i ładunku elektronu, spin ma orientację.Orientacja spinu jest wskazywana przez spinową liczbę kwantową, ms.
ms może być dodatnia lub ujemna.
Różnymi sposobami wyrażenia ms są zapisy:
– + lub –
– spin-up lub spin-down
–  lub
lub 
Na przykład na poniższym diagramie hel znajduje się w stanie podstawowym z elektronami.
Jeden z jego elektronów jest spin-up, drugi jest spin-down. Alternatywnie, jeden z jego elektronów ma spin dodatni, a drugi ujemny.
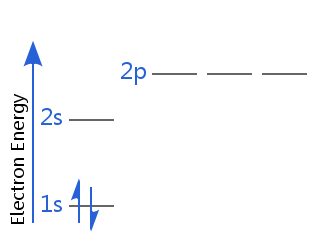
Zwykło się mówić, że każdy elektron w atomie jest w pełni scharakteryzowany przez cztery liczby kwantowe:
– n: główna liczba kwantowa
– l: orbitalna liczba kwantowa momentu pędu
– ml: magnetyczna liczba kwantowa
– ms: spinowa liczba kwantowa
Nie uwzględniamy s, ponieważ jego wartość nie zmienia się. Jest zawsze równa połowie. Tak więc wartość spinowej liczby kwantowej, ms, jest ogólnie zapisywana jako ±½.
Odkrycie spinu elektronu
Wbudowany lub wewnętrzny spin elektronu został po raz pierwszy wykryty przez Otto Sterna i Walthera Gerlacha w 1922 r. Jednak równanie falowe Erwina Schrödingera z 1926 r. nie uwzględniało go.
Wolfgang Pauli z powodzeniem wprowadził spin elektronu do mechaniki falowej jako dodatek.Trzy liczby kwantowe były już w użyciu; wprowadzenie spinu przez Pauliego uzupełniło kwantowy obraz elektronu w atomie wodoru.
W 1928 roku, słynne relatywistyczne równanie Paula Diraca dla elektronu, równanie Diraca, stworzyło spin elektronu jako naturalną konsekwencję fizyki kwantowej: spin nie był już dodatkiem.
