
Słowa kluczowe:
amorficzny,kryształ
Szkło na poziomie molekularnym
O szkle mówimy od czasu do czasu, gdy omawiamy polimery, zwłaszcza gdy mówimy o materiałach kompozytowych. Włókna szklane są często używane do wzmacniania polimerów. Ale czym jest to coś, co nazywa się szkłem? Oczywiście często używamy go z polimerami, ale czy samo szkło jest polimerem?
Zanim zajmiemy się tym pytaniem, spójrzmy, czym jest szkło. Najwyższej jakości szkło ma wzór chemiczny SiO2. Ale jest to mylące. Wzór ten przywodzi na myśl małe cząsteczki dwutlenku krzemu, analogiczne do cząsteczek dwutlenku węgla. Ale małe cząsteczki dwutlenku krzemu nie istnieją.

 Zamiast tego w naturze SiO2 często występuje jako krystaliczne ciało stałe, o strukturze takiej, jaką widać po prawej stronie. Każdy atom krzemu jest związany z czterema atomami tlenu, tetraedrycznie, oczywiście; i każdy atom tlenu jest związany z dwoma atomami krzemu. Kiedy SiO2 jest w tej krystalicznej formie, nazywamy go krzemionką. Widzieliście już krzemionkę. Kiedy znajdujemy jej wielkie kryształy, nazywamy ją kwarcem. Kiedy mamy dużo małych kryształków, nazywamy ją piaskiem.
Zamiast tego w naturze SiO2 często występuje jako krystaliczne ciało stałe, o strukturze takiej, jaką widać po prawej stronie. Każdy atom krzemu jest związany z czterema atomami tlenu, tetraedrycznie, oczywiście; i każdy atom tlenu jest związany z dwoma atomami krzemu. Kiedy SiO2 jest w tej krystalicznej formie, nazywamy go krzemionką. Widzieliście już krzemionkę. Kiedy znajdujemy jej wielkie kryształy, nazywamy ją kwarcem. Kiedy mamy dużo małych kryształków, nazywamy ją piaskiem.
Ale ta krzemionka to nie szkło. Musimy najpierw coś z nią zrobić, aby stała się szkłem. Musimy ją podgrzać, aż się rozpuści, a następnie bardzo szybko schłodzić. Kiedy się topi, atomy krzemu i tlenu wyłamują się ze swojej struktury krystalicznej. Gdybyśmy schładzali je powoli, atomy powoli ułożyłyby się z powrotem w krystaliczny układ w miarę spowalniania. (Pamiętaj, że ciepło to tak naprawdę tylko przypadkowy ruch atomów i cząsteczek. Gorące atomy poruszają się dużo, zimne atomy poruszają się bardzo mało.)
Jeśli jednak schłodzimy go wystarczająco szybko, atomy krzemionki zostaną zatrzymane w miejscu, że tak powiem. Nie będą miały czasu na ustawienie się w szeregu i utkną w dowolnym starym układzie. Będą wyglądały mniej więcej tak:v
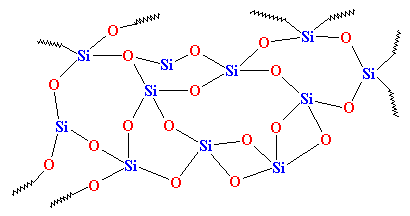
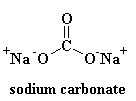
Jak widać, nie ma żadnego porządku w ułożeniu atomów. Materiały takie jak ten nazywamy amorficznymi. To jest szkło, które jest używane do soczewek teleskopów i takich rzeczy. Ma ono bardzo dobre właściwości optyczne, ale jest kruche. Do codziennych zastosowań potrzebujemy czegoś twardszego. Większość szkła jest robiona z piasku, a kiedy topimy piasek, zazwyczaj dodajemy trochę węglanu sodu. To daje nam twardsze szkło o strukturze, która wygląda tak:
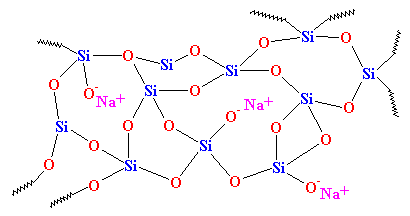
To jest szkło, które widzimy codziennie, w słoikach i oknach, i to jest szkło, które jest używane w kompozytach. W rzeczywistości, kiedyś nazywano je „szkłem sodowym”, aby odróżnić je od kwarcu.
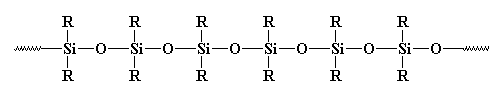
Czy to jest polimer czy nie? Zazwyczaj nie jest za taki uważany. Dlaczego? Niektórzy mogą powiedzieć, że jest nieorganiczny, a polimery są zazwyczaj organiczne. Ale istnieje wiele nieorganicznych polimerów. Na przykład, co z polisiloksanami? Te liniowe, i tak, nieorganiczne materiały mają strukturę bardzo podobną do szkła, i są uważane za polimery. Spójrzmy na polisiloksan:
So What About Crosslinking?
W jednym sensie szkło można by uznać za silnie usieciowany polisiloksan. Ale zazwyczaj nie myślimy o tym w ten sposób. Dlaczego? Prawdopodobnie dlatego, że nawet w systemie o wysokim stopniu usieciowania nadal można prześledzić łańcuch polimeru i zobaczyć, gdzie znajdują się wiązania krzyżowe. Ale w przypadku szkła byłoby to trudne do zrobienia.
Mamy tu porównanie, które ilustruje ten punkt: włókna węglowe i nanorurki węglowe. Dorzućmy do tego diament, aby ta rodzina była kompletna. „Jaka rodzina?” zapytacie. Po prostu ta, w której węgiel jest połączony z innymi węglami w dwu- lub trójwymiarowym układzie, i NIE jest połączony z niczym innym. Czysty węgiel!
Dlaczego całkowicie usieciowany węgiel nie jest polimerem?
Pamiętaj, że węgiel naprawdę chce być połączony z czterema innymi atomami. Zazwyczaj są to cztery różne inne atomy, ale wielokrotne wiązania z tym samym atomem również się liczą. W tym miejscu pojawia się większość monomerów winylowych: mają one podwójne wiązanie węgiel-węgiel, co oznacza, że każdy węgiel w winylu może być połączony tylko z dwoma innymi atomami oprócz węgla na drugim końcu podwójnego wiązania: cztery wiązania łącznie.
Teraz interesująca część. W grafenie, włóknach węglowych i nanorurkach węglowych, węgle są TYLKO związane z innymi atomami węgla. W tych związkach jednak, każdy węgiel ma kombinację podwójnych i pojedynczych wiązań, co czyni dla wysoce zdelokalizowanego zestawu orbitali molekularnych. Oznacza to, że materiały te przewodzą elektrony i są przewodnikami elektrycznymi. Ciekawy eksperyment: włóż garść włókien węglowych do mikrofalówki i zaparz je: płomień i dym, ponieważ elektrony poruszające się w materiale reagują z tlenem i idą z dymem!
Diament jest jeszcze bardziej interesujący, ponieważ jest najtwardszym znanym materiałem. Dlaczego jest tak twardy, a jednocześnie przezroczysty i potrafi tak pięknie załamywać światło? Jest to przecież czysty węgiel, ale z pewnym haczykiem: teraz każdy węgiel ma cztery pojedyncze wiązania z czterema innymi atomami węgla. Ten idealnie symetryczny układ węgli ma idealny układ wiązań idących w czterech różnych kierunkach. Można by rzec: „Nie ma nic lepszego niż to”.
Czy zatem te wszystkie sieci węglowe są uważane za polimery? Nie, i to z tego samego powodu, dla którego nie jest nimi szkło. Wszystko sprowadza się do konwencji i historii. Odkąd dowiedzieliśmy się, jak wygląda organiczny polimer, szkło i diament po prostu nie pasowały do siebie. Nieobiektywne, jeśli można tak powiedzieć, ponieważ spełniają one wymóg całkowicie usieciowanego polimeru. No cóż, inne bitwy do stoczenia…
 |
Powrót do Katalogu Poziomu Trzeciego |
 |
Powrót do katalogu Makrogalerii |