Cele nauczania
Do końca tego rozdziału, będziesz w stanie:
- Symbolizować skład cząsteczek za pomocą wzorów molekularnych i empirycznych
- Przedstawić układ wiązań atomów w cząsteczkach za pomocą wzorów strukturalnych
Wzór molekularny jest reprezentacją cząsteczki, która wykorzystuje symbole chemiczne do wskazania typów atomów, po których następują indeksy, aby pokazać liczbę atomów każdego typu w cząsteczce. (Indeks dolny jest używany tylko wtedy, gdy obecny jest więcej niż jeden atom danego typu). Wzory molekularne są również używane jako skróty nazw związków chemicznych.
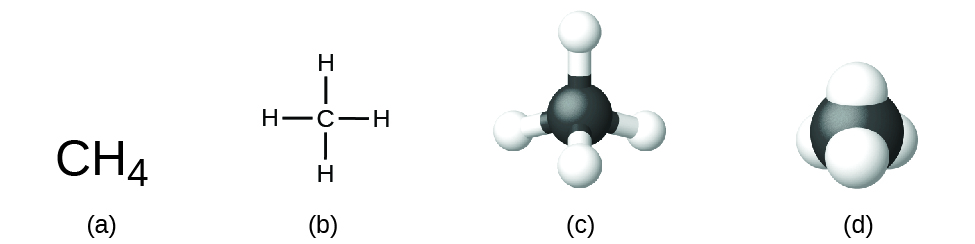
Wzór strukturalny związku podaje te same informacje co wzór molekularny (typy i liczby atomów w cząsteczce), ale pokazuje również, jak atomy są połączone w cząsteczce. Wzór strukturalny metanu zawiera symbole dla jednego atomu C i czterech atomów H, co wskazuje na liczbę atomów w cząsteczce (Rysunek 1). Linie reprezentują wiązania, które utrzymują atomy razem. (Wiązanie chemiczne to przyciąganie między atomami lub jonami, które utrzymuje je razem w cząsteczce lub krysztale). Omówimy wiązania chemiczne i zobaczymy, jak przewidzieć rozmieszczenie atomów w cząsteczce później. Na razie wystarczy wiedzieć, że linie wskazują, w jaki sposób atomy są połączone w cząsteczce. Model kulisty pokazuje geometryczne rozmieszczenie atomów z rozmiarami atomów bez skali, a model wypełniający przestrzeń pokazuje względne rozmiary atomów.
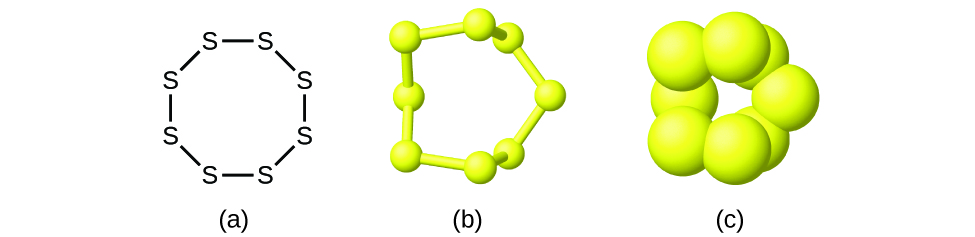
Ale wiele pierwiastków składa się z dyskretnych, pojedynczych atomów, niektóre istnieją jako cząsteczki składające się z dwóch lub więcej atomów pierwiastka chemicznie połączonych razem. Na przykład, większość próbek pierwiastków wodoru, tlenu i azotu składa się z cząsteczek zawierających po dwa atomy (zwanych cząsteczkami dwuatomowymi) i dlatego mają wzory cząsteczkowe odpowiednio H2, O2 i N2. Inne pierwiastki powszechnie występujące jako cząsteczki dwuatomowe to fluor (F2), chlor (Cl2), brom (Br2) i jod (I2). Najczęstszą formą pierwiastka siarki są cząsteczki składające się z ośmiu atomów siarki; jej wzór cząsteczkowy to S8 (Rysunek 2).
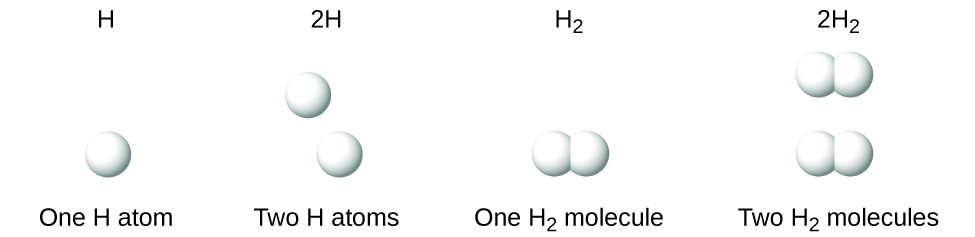
Należy zauważyć, że indeks dolny następujący po symbolu i liczba przed symbolem nie reprezentują tego samego; na przykład H2 i 2H reprezentują wyraźnie różne gatunki. H2 jest wzorem molekularnym; reprezentuje dwuatomową cząsteczkę wodoru, składającą się z dwóch atomów tego pierwiastka, które są chemicznie połączone. Wyrażenie 2H, z drugiej strony, oznacza dwa oddzielne atomy wodoru, które nie są połączone jako jednostka. Wyrażenie 2H2 reprezentuje dwie cząsteczki wodoru dwuatomowego (Rysunek 3).
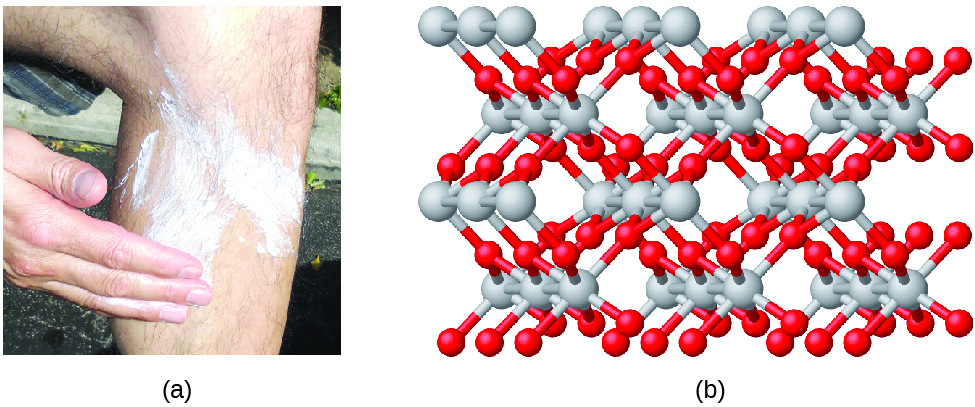
Związki tworzą się, gdy dwa lub więcej elementów łączy się chemicznie, co prowadzi do powstania wiązań. Na przykład, wodór i tlen mogą reagować tworząc wodę, a sód i chlor mogą reagować tworząc sól kuchenną. Czasami opisujemy skład tych związków za pomocą wzoru empirycznego, który wskazuje rodzaje obecnych atomów i najprostszy stosunek liczb całkowitych do liczby atomów (lub jonów) w związku. Na przykład, dwutlenek tytanu (używany jako pigment w białej farbie i w gęstych, białych, blokujących rodzajach filtrów przeciwsłonecznych) ma wzór empiryczny TiO2. Określa to pierwiastki tytan (Ti) i tlen (O) jako składniki dwutlenku tytanu i wskazuje na obecność dwukrotnie większej liczby atomów pierwiastka tlenu niż atomów pierwiastka tytanu (rysunek 4).
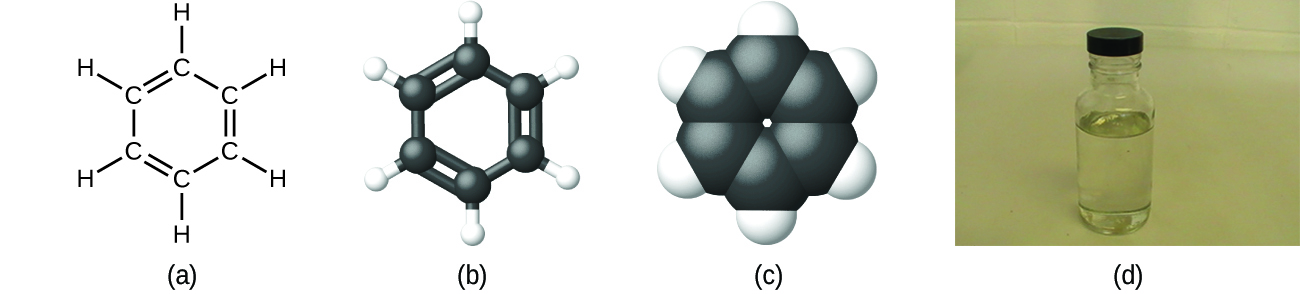
Jak już wcześniej wspomniano, możemy opisać związek za pomocą wzoru cząsteczkowego, w którym indeksy wskazują rzeczywiste liczby atomów każdego pierwiastka w cząsteczce związku. W wielu przypadkach wzór cząsteczkowy substancji jest wyprowadzany z doświadczalnego określenia zarówno jej wzoru empirycznego, jak i masy cząsteczkowej (sumy mas atomowych wszystkich atomów tworzących cząsteczkę). Na przykład, można doświadczalnie ustalić, że benzen zawiera dwa pierwiastki, węgiel (C) i wodór (H), oraz że na każdy atom węgla w benzenie przypada jeden atom wodoru. Zatem wzór empiryczny to CH. Doświadczalne określenie masy cząsteczkowej ujawnia, że cząsteczka benzenu zawiera sześć atomów węgla i sześć atomów wodoru, więc wzór cząsteczkowy dla benzenu to C6H6 (Rysunek 5).
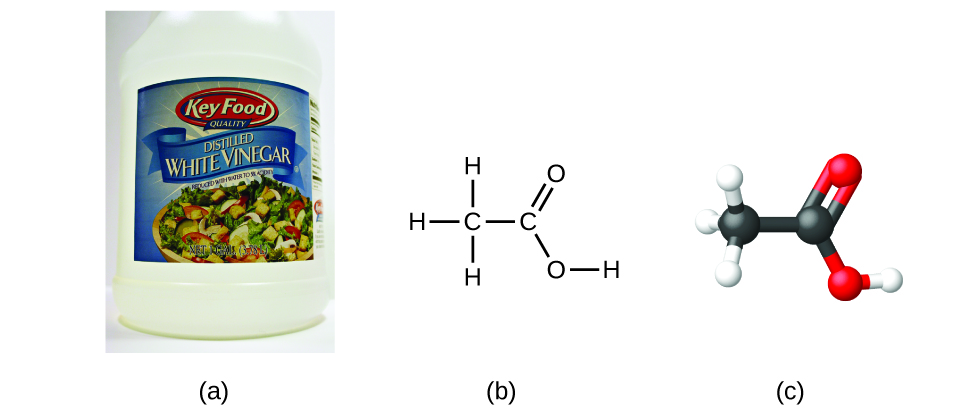
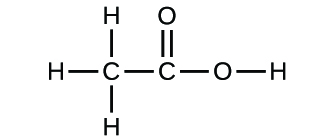
Jeśli znamy wzór związku, możemy łatwo wyznaczyć wzór empiryczny. (Jest to w pewnym sensie ćwiczenie akademickie; w praktyce zazwyczaj stosuje się odwrotną chronologię). Na przykład, wzór cząsteczkowy kwasu octowego, składnika nadającego octowi ostry smak, to C2H4O2. Wzór ten wskazuje, że cząsteczka kwasu octowego (Rysunek 6) zawiera dwa atomy węgla, cztery atomy wodoru i dwa atomy tlenu. Stosunek atomów wynosi 2:4:2. Dzieląc przez najmniejszy wspólny mianownik (2) otrzymujemy najprostszy, całoliczbowy stosunek atomów, 1:2:1, a więc wzór empiryczny to CH2O. Zauważ, że wzór cząsteczkowy jest zawsze wielokrotnością wzoru empirycznego.
Przykład 1
Wzory empiryczne i cząsteczkowe
Cząsteczki glukozy (cukru we krwi) zawierają 6 atomów węgla, 12 atomów wodoru i 6 atomów tlenu. Jakie są wzory molekularne i empiryczne glukozy?
Rozwiązanie
Wzór molekularny to C6H12O6, ponieważ jedna cząsteczka zawiera 6 atomów C, 12 atomów H i 6 atomów O. Najprostszy stosunek liczb całkowitych atomów C do H do O w glukozie wynosi 1:2:1, więc wzór empiryczny to CH2O.
Sprawdź swoją wiedzę
Cząsteczka metaldehydu (pestycydu używanego do zwalczania ślimaków) zawiera 8 atomów węgla, 16 atomów wodoru i 4 atomy tlenu. Jakie są wzory cząsteczkowe i empiryczne metaldehydu?
Podpowiedź:
Wzór cząsteczkowy, C8H16O4; wzór empiryczny, C2H4O

Możesz zbadać budowę cząsteczek za pomocą symulacji online.
Lee Cronin
Czym zajmują się chemicy? Według Lee Cronina (Rysunek 7), chemicy tworzą bardzo skomplikowane cząsteczki poprzez „siekanie” małych cząsteczek i „inżynierię odwrotną”. Zastanawia się on, czy moglibyśmy „stworzyć naprawdę fajny uniwersalny zestaw chemiczny” poprzez coś, co nazywa „aplikowaniem” chemii. Czy moglibyśmy „zaaplikować” chemię?
W wykładzie TED z 2012 roku Lee opisuje jedną fascynującą możliwość: połączenie kolekcji chemicznych „tuszy” z drukarką 3D zdolną do wytworzenia aparatury reakcyjnej (małe probówki, zlewki i tym podobne) w celu stworzenia „uniwersalnego zestawu narzędzi chemicznych”. Ten zestaw narzędzi może być używany do tworzenia leków dostosowanych do potrzeb klienta do walki z nową superbakterią lub do „drukowania” medycyny osobiście skonfigurowany do makijażu genetycznego, środowiska i sytuacji zdrowotnej. Jak mówi Cronin: „To, co Apple zrobił dla muzyki, ja chciałbym zrobić dla odkryć i dystrybucji leków na receptę”. Obejrzyj jego pełny wykład na stronie TED.

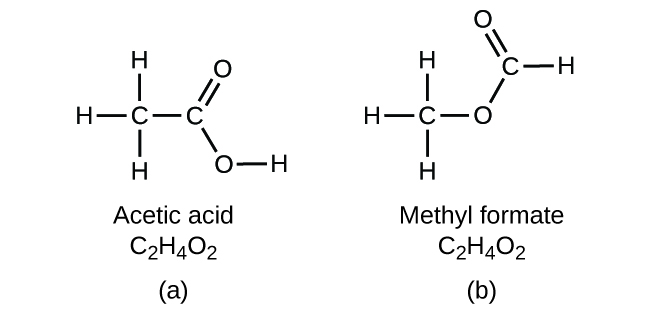
Ważne jest, aby mieć świadomość, że może być możliwe, aby te same atomy były ułożone w różny sposób: Związki o tym samym wzorze cząsteczkowym mogą mieć różne wiązania atom-atom, a zatem różne struktury. Na przykład, czy może istnieć inny związek o takim samym wzorze jak kwas octowy, C2H4O2? A jeśli tak, to jaka byłaby struktura jego cząsteczek?
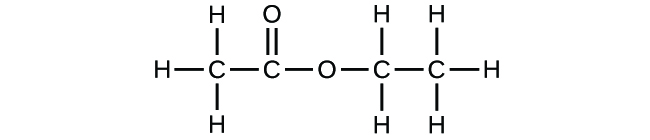
Jeśli przewidziałeś, że inny związek o wzorze C2H4O2 może istnieć, to wykazałeś się dobrą znajomością chemii i masz rację. Dwa atomy C, cztery atomy H i dwa atomy O mogą być również ułożone tak, aby utworzyć mrówczan metylu, który jest stosowany w produkcji, jako środek owadobójczy i do szybkoschnących wykończeń. Cząsteczki mrówczanu metylu mają jeden z atomów tlenu pomiędzy dwoma atomami węgla, co różni się od układu w cząsteczkach kwasu octowego. Kwas octowy i mrówczan metylu są przykładami izomerów – związków o tym samym wzorze chemicznym, ale różnej strukturze molekularnej (Rysunek 8). Należy zauważyć, że ta niewielka różnica w ułożeniu atomów ma duży wpływ na ich właściwości chemiczne. Z pewnością nie chcielibyście używać roztworu mrówczanu metylu jako substytutu roztworu kwasu octowego (octu) podczas robienia sosu sałatkowego.
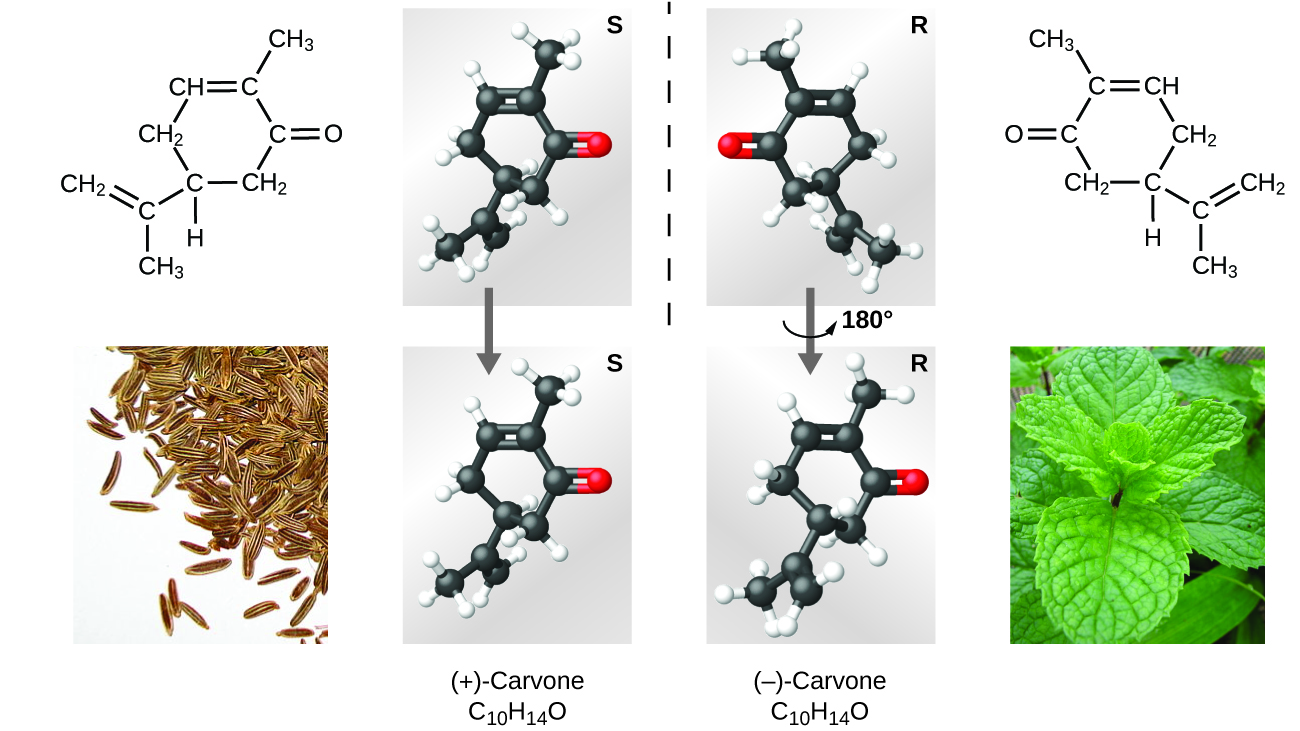
Istnieje wiele rodzajów izomerów (Rysunek 9). Kwas octowy i mrówczan metylu są izomerami strukturalnymi, czyli związkami, w których cząsteczki różnią się sposobem połączenia atomów ze sobą. Istnieją również różne rodzaje izomerów przestrzennych, w których względne orientacje atomów w przestrzeni mogą być różne. Na przykład, związek karwon (występujący w kminku, mięcie i skórkach pomarańczy mandarynki) składa się z dwóch izomerów, które są lustrzanymi odbiciami siebie nawzajem. S-(+)-karwon pachnie jak kminek, a R-(-)-karwon pachnie jak mięta.

Wybierz ten link, aby zobaczyć wyjaśnienie izomerów, izomerów przestrzennych i dlaczego mają one różne zapachy (wybierz film zatytułowany „Lustrzana cząsteczka: Carvone”).
Wzór cząsteczkowy wykorzystuje symbole chemiczne i indeksy, aby wskazać dokładną liczbę różnych atomów w cząsteczce lub związku. Wzór empiryczny podaje najprostszy, całoliczbowy stosunek atomów w związku. Wzór strukturalny wskazuje układ wiązań atomów w cząsteczce. Modele kulkowo-klejowe i wypełniające przestrzeń pokazują geometryczne rozmieszczenie atomów w cząsteczce. Izomery są związkami o tym samym wzorze molekularnym, ale różnym rozmieszczeniu atomów.
Chemia – ćwiczenia na koniec rozdziału
- Wyjaśnij, dlaczego symbol atomu pierwiastka tlenu i wzór na cząsteczkę tlenu różnią się od siebie.
- Wyjaśnij, dlaczego symbol pierwiastka siarki i wzór na cząsteczkę siarki różnią się od siebie.
- Pisz wzory cząsteczkowe i empiryczne następujących związków:
(a)
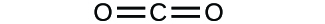
(b)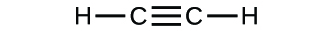
(c)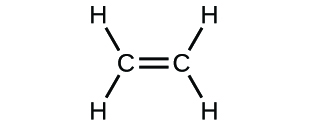
(d)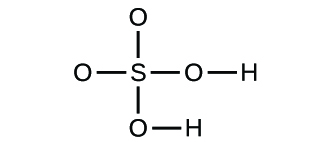
- Pisz wzory cząsteczkowe i empiryczne następujących związków:
(a)
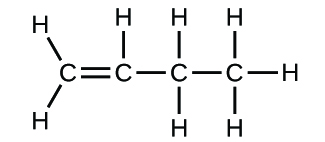
(b)
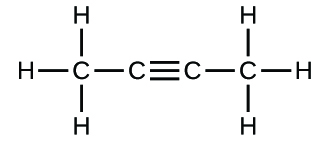
(c)
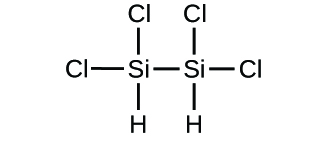
(d)
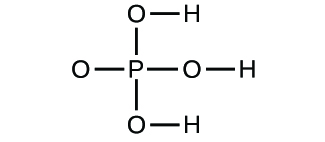
- Określ wzory empiryczne dla następujących związków:
(a) kofeina, C8H10N4O2
(b) fruktoza, C12H22O11
(c) nadtlenek wodoru, H2O2
(d) glukoza, C6H12O6
(e) kwas askorbinowy (witamina C), C6H8O6
- Określ wzory empiryczne następujących związków:
(a) kwas octowy, C2H4O2
(b) kwas cytrynowy, C6H8O7
(c) hydrazyna, N2H4
(d) nikotyna, C10H14N2
(e) butan, C4H10
- Pisz wzory empiryczne następujących związków:
(a)
(b)
- Otwórz symulację Build a Molecule i wybierz zakładkę „Larger Molecules”. Wybierz odpowiedni „Zestaw” atomów, aby zbudować cząsteczkę z dwoma atomami węgla i sześcioma atomami wodoru. Przeciągnij atomy do przestrzeni nad „Zestawem”, aby utworzyć cząsteczkę. Nazwa pojawi się, gdy stworzysz rzeczywistą cząsteczkę, która istnieje (nawet jeśli nie jest to ta, którą chcesz). Możesz użyć narzędzia nożyczek do rozdzielenia atomów, jeśli chcesz zmienić połączenia. Kliknij na „3D”, aby zobaczyć cząsteczkę, i przyjrzyj się zarówno możliwościom wypełnienia przestrzeni, jak i możliwościom kulistym.
(a) Narysuj wzór strukturalny tej cząsteczki i podaj jej nazwę.
(b) Czy możesz ułożyć te atomy w dowolny sposób, aby stworzyć inny związek?
- Użyj symulacji Zbuduj cząsteczkę, aby powtórzyć ćwiczenie nr 8, ale zbuduj cząsteczkę z dwoma węglami, sześcioma hydrogenami i jednym tlenem.
(a) Narysuj wzór strukturalny tej cząsteczki i podaj jej nazwę.
(b) Czy możesz rozmieścić te atomy tak, aby powstała inna cząsteczka? Jeśli tak, to narysuj jej wzór strukturalny i podaj nazwę.
(c) W jaki sposób cząsteczki narysowane w (a) i (b) są takie same? Czym się różnią? Jak się nazywają (rodzaj związku między tymi cząsteczkami, nie ich nazwy).
- Użyj symulacji Zbuduj cząsteczkę, aby powtórzyć ćwiczenie 8 z Chemii na koniec rozdziału, ale zbuduj cząsteczkę z trzema węglami, siedmioma hydrogenami i jednym chlorem.
(a) Narysuj wzór strukturalny tej cząsteczki i podaj jej nazwę.
(b) Czy możesz rozmieścić te atomy tak, aby powstała inna cząsteczka? Jeśli tak, to narysuj jej wzór strukturalny i podaj nazwę.
(c) W jaki sposób cząsteczki narysowane w (a) i (b) są takie same? Czym się różnią? Jak się nazywają (rodzaj związku między tymi cząsteczkami, nie ich nazwy)?
Słowniczek
wzór empiryczny wzór określający skład związku podany jako najprostszy stosunek liczb całkowitych atomów izomery związki o tym samym wzorze chemicznym, ale różnej budowie wzór cząsteczkowy wzór określający skład cząsteczki związku i podający rzeczywistą liczbę atomów każdego pierwiastka w cząsteczce związku. izomery przestrzenne związki, w których różnią się względne orientacje atomów w przestrzeni wzór strukturalny przedstawia atomy w cząsteczce i sposób ich połączenia izomer strukturalny jedna z dwóch substancji, które mają ten sam wzór cząsteczkowy, ale różne właściwości fizyczne i chemiczne, ponieważ ich atomy są inaczej związane
Rozwiązania
Odpowiedzi do ćwiczeń z chemii na koniec rozdziału
1. Symbol pierwiastka tlenu, O, reprezentuje zarówno pierwiastek, jak i jeden atom tlenu. Cząsteczka tlenu, O2, zawiera dwa atomy tlenu; indeks 2 we wzorze musi być użyty, aby odróżnić cząsteczkę dwuatomową od dwóch pojedynczych atomów tlenu.
3. a) cząsteczkowy CO2, empiryczny CO2; b) cząsteczkowy C2H2, empiryczny CH; c) cząsteczkowy C2H4, empiryczny CH2; d) cząsteczkowy H2SO4, empiryczny H2SO4
5. (a) C4H5N2O; (b) C12H22O11; (c) HO; (d) CH2O; (e) C3H4O3
7. (a) CH2O; (b) C2H4O
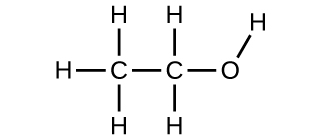
9. (a) etanol
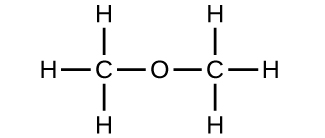
(b) metoksymetan, bardziej znany jako eter dimetylowy
(c) Te cząsteczki mają taki sam skład chemiczny (rodzaje i liczbę atomów), ale różną strukturę chemiczną. Są to izomery strukturalne.
- Lee Cronin, „Print Your Own Medicine,” Rozmowa przedstawiona na TED Global 2012, Edynburg, Szkocja, czerwiec 2012. ↵