Cele nauczania
- Określić wrażliwość różnych gatunków bakterii na różne antybiotyki i środki syntetyczne.
Prawdziwy antybiotyk to przeciwdrobnoustrojowa substancja chemiczna wytwarzana przez mikroorganizmy przeciwko innym mikroorganizmom. Ludzkość bardzo dobrze wykorzystała te środki przeciwdrobnoustrojowe w swojej walce z chorobą zakaźną. Wiele leków jest obecnie całkowicie syntetycznych lub naturalne leki są manipulowane w celu zmiany ich struktury, te ostatnie nazywane są półsyntetykami. Bakterie reagują w różny sposób na antybiotyki i leki chemosyntetyczne, nawet w obrębie tego samego gatunku. Na przykład, Staphylococcus aureus jest powszechną bakterią normalnej flory występującą w organizmie. Jeśli ktoś wyizolowałby tę bakterię od 5 różnych osób, te 5 izolatów prawdopodobnie byłoby różnymi szczepami, czyli nieznacznie różniącymi się genetycznie. Jest również prawdopodobne, że gdyby testy wrażliwości na antybiotyki były wykonywane na tych izolatach, wyniki różniłyby się w stosunku do różnych stosowanych antybiotyków.
Test Kirby-Bauera na wrażliwość na antybiotyki (zwany również testem dyfuzyjnym) jest standardem stosowanym od lat. Po raz pierwszy został opracowany w latach 50. ubiegłego wieku, następnie udoskonalony przez W. Kirby’ego i A. Bauera, a w 1961 r. znormalizowany przez Światową Organizację Zdrowia. W laboratoriach klinicznych został wyparty przez testy automatyczne. Jednakże, K-B jest nadal używany w niektórych laboratoriach, lub używany z niektórymi bakteriami, z którymi automatyzacja nie działa dobrze. Test ten jest używany do określenia oporności lub wrażliwości bakterii tlenowych lub beztlenowych na określone substancje chemiczne, które mogą być następnie wykorzystane przez lekarza klinicystę w leczeniu pacjentów z infekcjami bakteryjnymi. Obecność lub brak obszaru hamującego wokół krążka identyfikuje wrażliwość bakterii na dany lek (Rysunek ®).
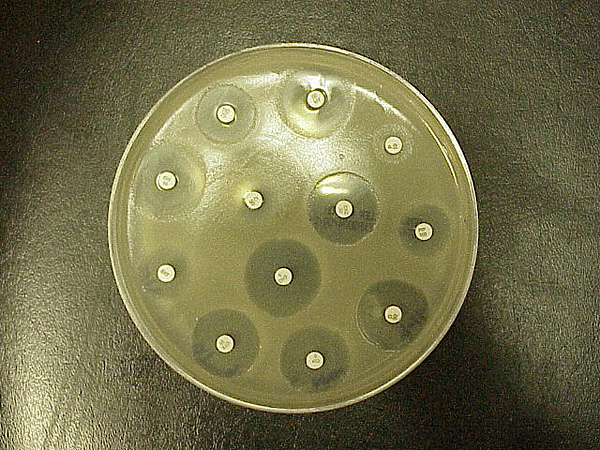
Podstawy są proste: bakteria jest wymazana na agarze, a na wierzchu umieszcza się krążki z antybiotykiem. Antybiotyk dyfunduje z krążka do agaru w coraz mniejszych ilościach, im dalej znajduje się od krążka. Jeśli organizm jest zabity lub zahamowany przez stężenie antybiotyku, nie będzie wzrostu w bezpośrednim obszarze wokół krążka: Nazywa się to strefą zahamowania (rysunek 9.1). Rozmiary strefy są sprawdzane na standardowym wykresie w celu uzyskania wyniku wrażliwego, opornego lub pośredniego. Wiele wykresów ma odpowiednią kolumnę, która podaje również MIC (minimalne stężenie hamujące) dla danego leku. MIC jest obecnie standardowym testem do badania wrażliwości na antybiotyki, ponieważ daje bardziej istotne informacje na temat minimalnych dawek.
Podłoże Mueller-Hinton używane do testu Kirby-Bauera jest bardzo bogate w białko.
POTRZEBNE MATERIAŁY: na tabelę
- 2 płytki agarowe Mueller-Hinton
- 24-godzinne hodowle (prawdopodobnie Staph, E. coli, Bacillus subtilus, Enterococcus fecalis) sterylne wymazy
- antybiotyki
- etanol
- kostki
- płytki Pseudomonas aeruginosa Kirby-Bauera
- karta wytycznych do interpretacji wrażliwości na antybiotyki
ZABIEGI
iv PROCEDURY
Drugie pokrycie wymazu ►

- Poddać wymazowi płytkę Mueller- -Hinton z TYLKO 2 wymazami.Hintona z TYLKO 2 bakteriami (w tabelach znajdą się różne kombinacje 4 bakterii). Zanurz sterylny wacik w bulionie i odciśnij nadmiar wilgoci, dociskając wacik do ścianki probówki.
- Wyczyść całkowicie powierzchnię agaru (nie chcesz pozostawić żadnych nieprzemytych obszarów agaru). Na poniższych zdjęciach widać, co się dzieje, gdy płytka nie jest wymazana prawidłowo, z równomiernym pokryciem bakterii na całej powierzchni agaru.
- Po całkowitym wymazaniu płytki, obróć ją o 90 stopni i powtórz proces wymazywania. (Nie jest konieczne ponowne zwilżanie wacika.) Przesuń wacik po obwodzie płytki przed wyrzuceniem go do woreczka na odpady.
- Pozwól powierzchni wyschnąć przez około 5 minut przed umieszczeniem krążków z antybiotykami na agarze.
- KRĄŻKI ANTYBIOTYCZNE:
- Używasz indywidualnych dozowników antybiotyków.
-
 Będziesz prawdopodobnie musiał użyć pary kleszczyków do wyjęcia krążka antybiotyku z dozownika: kleszczyki muszą być sterylne. Umieść szczypce w alkoholu, podpal je, aż się zapalą, pozwól płomieniowi zgasnąć—- sterylne szczypce.
Będziesz prawdopodobnie musiał użyć pary kleszczyków do wyjęcia krążka antybiotyku z dozownika: kleszczyki muszą być sterylne. Umieść szczypce w alkoholu, podpal je, aż się zapalą, pozwól płomieniowi zgasnąć—- sterylne szczypce. - Lekko dotknij każdego krążka sterylną pętlą inokulacyjną, aby upewnić się, że ma on dobry kontakt z powierzchnią agaru. Inkubować do góry nogami i inkubować w temperaturze 37o C.
INTERPRETACJA
-
 Umieścić metryczną linijkę w poprzek strefy zahamowania, w najszerszej średnicy, i zmierzyć od jednej krawędzi strefy do drugiej krawędzi. PRZYWIESZENIE PŁYTY DO ŚWIATŁA MOŻE POMÓC.
Umieścić metryczną linijkę w poprzek strefy zahamowania, w najszerszej średnicy, i zmierzyć od jednej krawędzi strefy do drugiej krawędzi. PRZYWIESZENIE PŁYTY DO ŚWIATŁA MOŻE POMÓC. - Użyj pomiarów w milimetrach. Średnica tarczy będzie w rzeczywistości częścią tej liczby.
- Jeśli nie ma żadnej strefy w ogóle, zgłoś to jako 0—nawet jeśli sama tarcza ma około 7 mm.
- Średnica strefy jest podawana w milimetrach, sprawdzana na wykresie, a wynik podawany jako wrażliwy, odporny lub pośredni.
- Zapisz wyniki dla swojej tabeli, jak również dla innych tabel, w tabeli.
|
Antybiotyk (środek przeciwdrobnoustrojowy) |
DISC CODE |
Odporny (< lub = mm) |
Średniozaawansowany (mm) |
Podatny (= lub > mm) |
|
|---|---|---|---|---|---|
| Amoksycylina (inne) | AMC | <13 | 14-.17 | mm)” style=”text-sprzymierzyć się:centrum;” class=”lt-bio-3483″>>18 | |
| Amoksycylina (Staph) | AMC | 19 | mm)” style=”text-.sprzymierzyć się:centrum;” class=”lt-bio-3483″>20 | ||
| Ampicylina (inne) | AM | 11 | 12-.13 | mm)” style=”text-sprzymierzyć się:centrum;” class=”lt-bio-3483″>14 | |
| Ampicylina (Staph) | AM | 28 | mm)” style=”text-sprzymierzyć się:centrum;” class=”lt-bio-3483″>29 | ||
| Carbenicylina (inne) | CB | 17 | 18- | 17 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>23 |
| Carbenicylina (Pseudomonas) | CB | 13 | 14-.16 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>17 | |
| Cefoxitin | FOX | 14 | 15-.17 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>18 | |
| Cephalothin | CF | 14 | 15-.17 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>18 | |
| Chloramfenikol | C | 12 | 13-….17 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>18 | |
| Ciprofloksacyna | CIP-.5 | 15 | 16-20 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>21 | |
| Clindamycyna | CC-.2 | 14 | 15-20 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>21 | |
| Enoxacin (Fluoroquinolone, 2nd gen.) | ENX-10 | 14 | 15-17 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>18 | |
| Erthromycin | E | 13 | 14-.22 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>23 | |
| Gentamycyna | GM | 12 | 13-.14 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>15 | |
| Kanamycyna | K-.30 | 13 | 14-17 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>18 | |
| Metycylina (Staph) | M(orDP) | 9 | 10-.13 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>14 | |
| Oxacillin (Staph) | OX | 10 | 11-.12 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>13 | |
| Penicylina G (Enterococcus) | P | 14 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>15 | ||
| Penicylina G (Staph) | P | 28 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>29 | ||
| Streptomycyna | S-.10 | 14 | 15-20 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>21 | |
| Sulfametoksazol-.trimetoprim | SXT | 10 | 11-15 | mm)” style=”text-align:centrum;” class=”lt-bio-3483″>16 | |
| Tetracyklina | Te-…30 | 14 | 15-18 | mm)” style=”text-align:center;” class=”lt-bio-3483″>19 | |
| Tobramycyna | NN-.10 | 12 | 13-14 | mm)” style=”text-align:center;” class=”lt-bio-3483″>15 | |
| Wankomycyna | Va-.30 | 9 | 10-11 | mm)” style=”text-align:center;” class=”lt-bio-3483″>12 |
TABELA DLA WYNIKÓW
Zapisać wyniki dla 5 bakterii z zastosowaniem wszystkich antybiotyków.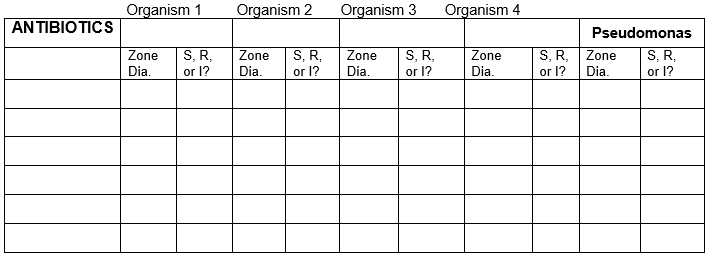
Średnica strefy w jednostkach milimetrowych. Użyj wykresu dla wrażliwych, opornych lub średnio wrażliwych
PYTANIA
- Im większy rozmiar strefy, tym bardziej ____________ bakteria jest wrażliwa na ten antybiotyk.
- Jakie jednostki miary są używane do pomiaru rozmiarów strefy?
- Jak wrażliwość Staph porównuje się z wrażliwością Pseudomonas?
Wykonawcy
-
Jackie Reynolds, profesor biologii (Richland College)