Porquê ligar os átomos uns aos outros?
Abservar os átomos uns com os outros para que possam baixar a sua energia e tornar-se estáveis. E como os átomos se ligam a outros átomos, muitas vezes fazem moléculas com propriedades químicas e físicas únicas. Vamos usar o modelo abaixo para explicar como os átomos se ligam para se tornarem estáveis.
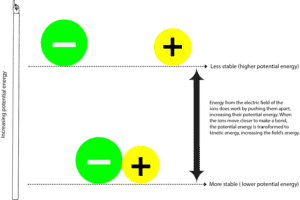
Quando o átomo carregado negativamente (ânion) e o átomo carregado positivamente (catião) formam uma ligação, são normalmente mais estáveis com menor energia potencial. A energia potencial é a energia devido às posições relativas destes iões no campo eléctrico que os rodeia. O campo eléctrico é uma área em que uma força se exerce a si própria. Em alguns aspectos, um campo eléctrico é semelhante a um campo magnético. E é possível ver estas linhas de força em torno de um campo magnético quando se espalha limalhas de ferro à sua volta.
Para separar o ião negativo do positivo, o campo eléctrico que rodeia os iões tem de fazer o seu trabalho, afastando estes iões. Como o campo eléctrico faz isto, também transfere energia para estas partículas, aumentando a sua energia potencial. Pode-se relacionar este processo com o puxar de dois ímanes que são atraídos um pelo outro. Neste caso, é o campo de força que suplanta a energia para as separar, e à medida que as separa, os ímanes aumentam a sua energia potencial. E porque têm de fazer mais trabalho para se afastarem de cada um deles, tornam-se instáveis. Assim que se soltam, os dois ímanes são rapidamente atraídos um pelo outro, diminuindo a sua energia potencial. Agora,
para onde foi o resto da energia potencial?
Essa energia foi transferida de volta para si e para o meio envolvente sob a forma de energia cinética. A energia cinética é a energia que um objecto tem quando se move, e muitas vezes sentimos esta energia como calor. Assim, sempre que se sente calor, isso significa que a energia se move de um lugar mais quente para um lugar mais frio. Ou dito de outra forma, de uma fonte mais concentrada para uma fonte menos concentrada. Tenha em mente que a energia nunca pode ser transferida do contrário – de um lugar mais frio para um lugar mais quente.
Assim, à medida que a energia é transferida de e para o campo ou de e para o universo, normalmente dizemos que a energia é conservada. O que significa que não podemos criar ou destruir energia, só a podemos converter de uma forma para outra. Isso é de energia potencial para energia cinética e de energia cinética para energia potencial.
O que é que os átomos usam para se ligarem a outros átomos?
Os átomos usam os seus electrões de valência para se ligarem a outros átomos. E para os átomos se ligarem, devem fazer pelo menos uma das seguintes coisas;
- ganhar electrões de outros átomos
- perder electrões para outros átomos
- partilhar electrões com outros átomos
E recordar que os electrões de valência ocupam a maior energia orbital de um átomo. E pode visualizar estes electrões quando escreve a configuração dos electrões para um átomo. Se fizer com os elementos principais do grupo do primeiro e segundo período, notará que o hidrogénio tem um electrão de valência, o azoto tem 5, o oxigénio tem 6 e o néon tem 8,
Se desenharmos estes electrões de valência colocando ponto(s) em cima, à direita, em baixo e do lado esquerdo dos seus símbolos químicos, obteremos estes diagramas simples chamados diagramas de pontos de Lewis, nomeados em honra de Lewis, que foi o primeiro a utilizá-los para explicar a ideia de ligação. Agora, vamos continuar a discutir a colagem com as seguintes estruturas de Lewis:
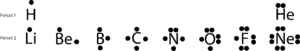
Se olhar para os elementos do segundo período, notará que apenas Neon (Ne) tem dois electrões em cada um dos seus quatro lados. Se somar todos os electrões dos quatro lados, descobrirá que há oito electrões à sua volta.
O número oito está ligado ao último dígito do número do grupo Ne pertence, grupo 18. Este grupo especial de elementos, chamados os gases nobres, tendem a ser estáveis e não reactivos em condições normais. Com excepção do hélio, todos eles têm oito electrões de valência no grupo.
Por causa do seu comportamento químico, Lewis foi capaz de deduzir que para que os outros elementos atinjam uma configuração estável como os gases nobres, devem reagir com outros átomos para o conseguirem. A partir desta conclusão, Lewis propôs a regra do octeto. A regra dos oito.
Mas há excepções, como se pode ver, o hidrogénio só precisa de dois electrões para alcançar uma configuração estável semelhante à de He. Apesar desta e de outras falhas, as estruturas de pontos de Lewis podem explicar como os átomos se ligam de uma forma simples sem que desenhemos orbitais atómicos complexos.
O que faz com que os átomos se liguem a outros átomos?
Energy! A energia é normalmente a força motriz por detrás da ligação. Para os átomos se ligarem, os átomos devem atingir um equilíbrio delicado entre as forças atractivas e repulsivas dos seus núcleos e electrões. Para saber como dois átomos de hidrogénio partilham electrões para criar a molécula de hidrogénio, clique aqui.