Objectivos de aprendizagem
No final desta secção, poderá fazê-lo:
- Symbolizar a composição das moléculas usando fórmulas moleculares e fórmulas empíricas
- Representar a disposição de ligação dos átomos dentro das moléculas usando fórmulas estruturais
Uma fórmula molecular é uma representação de uma molécula que usa símbolos químicos para indicar os tipos de átomos seguidos por subscritos para mostrar o número de átomos de cada tipo na molécula. (Um subscrito é utilizado apenas quando está presente mais de um átomo de um determinado tipo). As fórmulas moleculares são também usadas como abreviaturas para os nomes dos compostos.
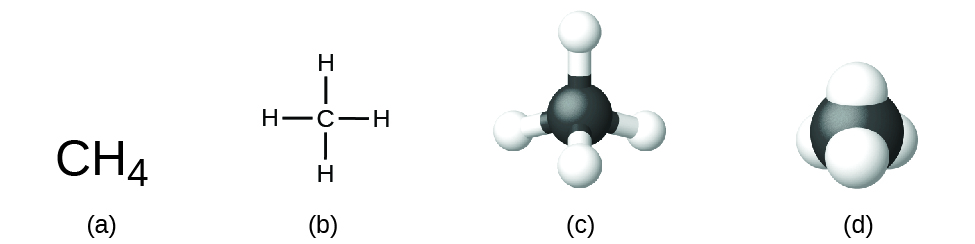
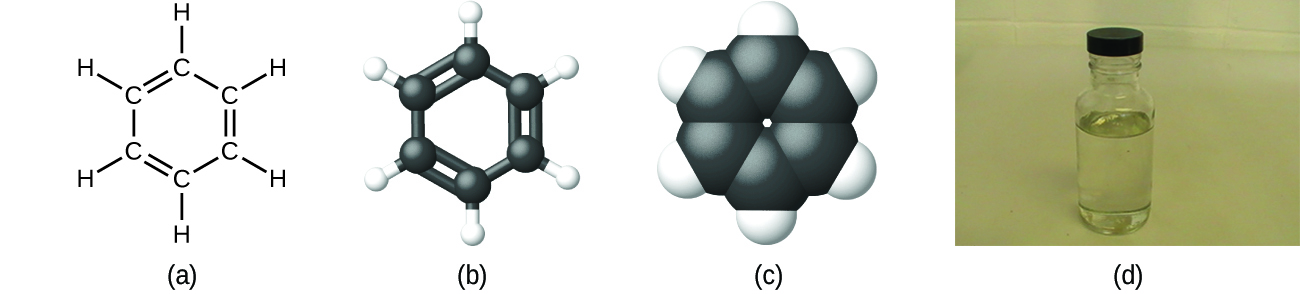
A fórmula estrutural de um composto dá a mesma informação que a sua fórmula molecular (os tipos e números de átomos na molécula) mas também mostra como os átomos estão ligados na molécula. A fórmula estrutural para o metano contém símbolos para um átomo C e quatro átomos H, indicando o número de átomos na molécula (Figura 1). As linhas representam ligações que mantêm os átomos juntos. (Uma ligação química é uma atracção entre átomos ou iões que os mantém unidos numa molécula ou num cristal). Discutiremos as ligações químicas e veremos como prever a disposição dos átomos numa molécula mais tarde. Por agora, saiba simplesmente que as linhas são uma indicação de como os átomos estão ligados numa molécula. Um modelo de bola e bastão mostra a disposição geométrica dos átomos com tamanhos atómicos não à escala, e um modelo de preenchimento de espaço mostra os tamanhos relativos dos átomos.
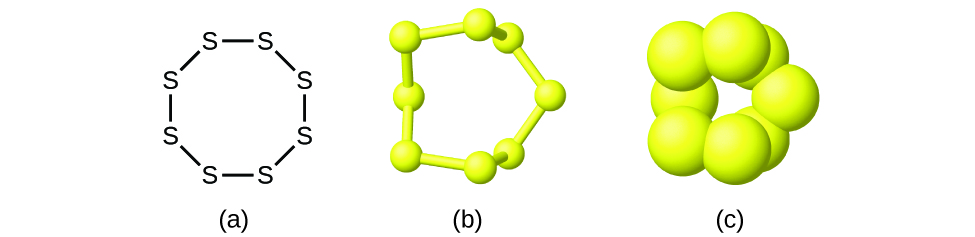
Embora muitos elementos consistam em átomos discretos e individuais, alguns existem como moléculas constituídas por dois ou mais átomos do elemento quimicamente ligados entre si. Por exemplo, a maioria das amostras dos elementos hidrogénio, oxigénio e azoto são compostas de moléculas que contêm dois átomos cada (chamadas moléculas diatómicas) e, portanto, têm as fórmulas moleculares H2, O2, e N2, respectivamente. Outros elementos normalmente encontrados como moléculas diatómicas são flúor (F2), cloro (Cl2), bromo (Br2), e iodo (I2). A forma mais comum do elemento enxofre é composta de moléculas que consistem em oito átomos de enxofre; a sua fórmula molecular é S8 (Figura 2).
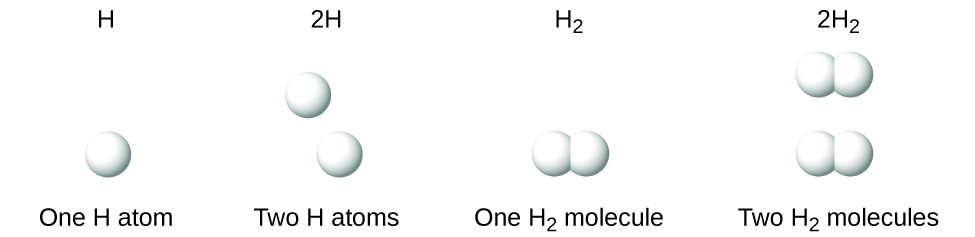
É importante notar que um subscrito que segue um símbolo e um número em frente de um símbolo não representam a mesma coisa; por exemplo, H2 e 2H representam espécies distintamente diferentes. H2 é uma fórmula molecular; representa uma molécula diatómica de hidrogénio, constituída por dois átomos do elemento que estão quimicamente ligados entre si. A expressão 2H, por outro lado, indica dois átomos de hidrogénio separados que não estão combinados como uma unidade. A expressão 2H2 representa duas moléculas de hidrogénio diatómico (Figura 3).
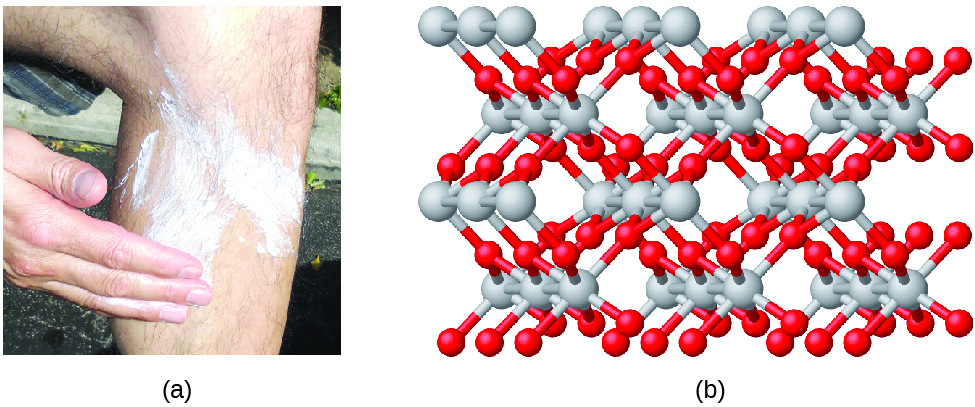
Compounds são formados quando dois ou mais elementos se combinam quimicamente, resultando na formação de ligações. Por exemplo, o hidrogénio e o oxigénio podem reagir para formar água, e o sódio e o cloro podem reagir para formar sal de mesa. Descrevemos por vezes a composição destes compostos com uma fórmula empírica, que indica os tipos de átomos presentes e a mais simples relação de número inteiro do número de átomos (ou iões) no composto. Por exemplo, o dióxido de titânio (utilizado como pigmento em tinta branca e no tipo de protecção solar espesso, branco e bloqueador) tem uma fórmula empírica de TiO2. Isto identifica os elementos titânio (Ti) e oxigénio (O) como constituintes do dióxido de titânio, e indica a presença do dobro de átomos do elemento oxigénio do que os átomos do elemento titânio (Figura 4).
Como discutido anteriormente, podemos descrever um composto com uma fórmula molecular, em que os subscritos indicam o número real de átomos de cada elemento numa molécula do composto. Em muitos casos, a fórmula molecular de uma substância deriva da determinação experimental tanto da sua fórmula empírica como da sua massa molecular (a soma das massas atómicas de todos os átomos que compõem a molécula). Por exemplo, pode ser determinado experimentalmente que o benzeno contém dois elementos, carbono (C) e hidrogénio (H), e que para cada átomo de carbono no benzeno, existe um átomo de hidrogénio. Assim, a fórmula empírica é CH. Uma determinação experimental da massa molecular revela que uma molécula de benzeno contém seis átomos de carbono e seis átomos de hidrogénio, pelo que a fórmula molecular do benzeno é C6H6 (Figura 5).
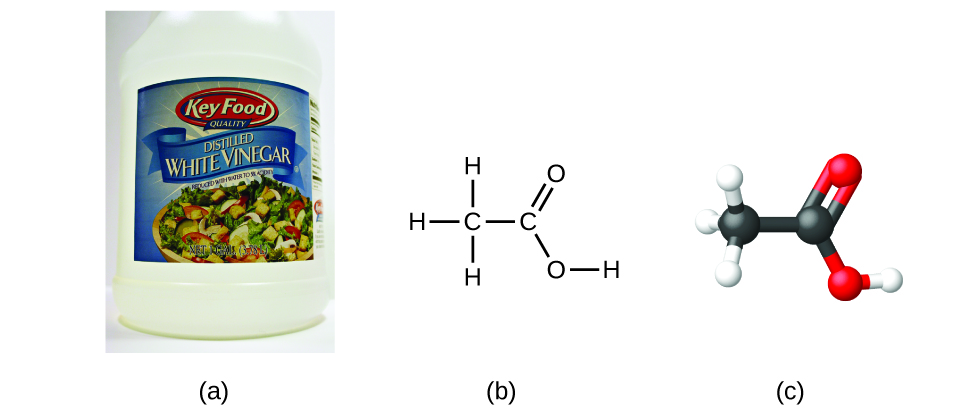
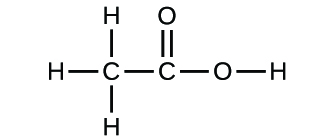
Se conhecermos a fórmula de um composto, podemos facilmente determinar a fórmula empírica. (Isto é de certa forma um exercício académico; a cronologia inversa é geralmente seguida na prática real). Por exemplo, a fórmula molecular do ácido acético, o componente que dá ao vinagre o seu sabor afiado, é C2H4O2. Esta fórmula indica que uma molécula de ácido acético (Figura 6) contém dois átomos de carbono, quatro átomos de hidrogénio, e dois átomos de oxigénio. A proporção de átomos é de 2:4:2. Dividindo-se pelo menor denominador comum (2), obtém-se a razão de átomos mais simples, 1:2:1, pelo que a fórmula empírica é CH2O. Note-se que uma fórmula molecular é sempre um múltiplo de número inteiro de uma fórmula empírica.
Exemplo 1
Fórmulas Empíricas e Moleculares
Moléculas de glucose (açúcar no sangue) contêm 6 átomos de carbono, 12 átomos de hidrogénio, e 6 átomos de oxigénio. Quais são as fórmulas moleculares e empíricas da glucose?
Solução
A fórmula molecular é C6H12O6 porque uma molécula contém efectivamente 6 C, 12 H, e 6 O átomos. A razão mais simples de número inteiro de átomos C para H para O na glucose é 1:2:1, por isso a fórmula empírica é CH2O.
Check Your Learning
Uma molécula de metaldeído (um pesticida usado para caracóis e lesmas) contém 8 átomos de carbono, 16 átomos de hidrogénio, e 4 átomos de oxigénio. Quais são as fórmulas moleculares e empíricas do metaldeído?
Resposta:
Fórmula molecular, C8H16O4; fórmula empírica, C2H4O

P>P>Pode explorar a construção de moléculas usando uma simulação em linha.
Lee Cronin
O que é que os químicos fazem? De acordo com Lee Cronin (Figura 7), os químicos fazem moléculas muito complicadas “cortando” pequenas moléculas e “engenharia inversa”. Ele pergunta-se se poderíamos “fazer um conjunto de química universal muito fixe” pelo que ele chama de química “app-ing”. Poderíamos “aplicar” química?
Numa palestra TED de 2012, Lee descreve uma possibilidade fascinante: combinar uma colecção de “tintas” químicas com uma impressora 3D capaz de fabricar um aparelho de reacção (pequenos tubos de ensaio, copos, e afins) para criar um “conjunto de ferramentas universais de química”. Este kit de ferramentas poderia ser utilizado para criar medicamentos personalizados para combater um novo superbug ou para “imprimir” medicamentos configurados pessoalmente à sua composição genética, ambiente e situação de saúde. Diz Cronin, “O que a Apple fez pela música, gostaria de fazer pela descoberta e distribuição de medicamentos prescritos”. Veja a sua palestra completa no website do TED.

É importante estar ciente de que pode ser possível que os mesmos átomos sejam dispostos de formas diferentes: Compostos com a mesma fórmula molecular podem ter diferentes ligações átomo-a-atom e, portanto, diferentes estruturas. Por exemplo, poderia haver outro composto com a mesma fórmula do ácido acético, C2H4O2? E se assim for, qual seria a estrutura das suas moléculas?
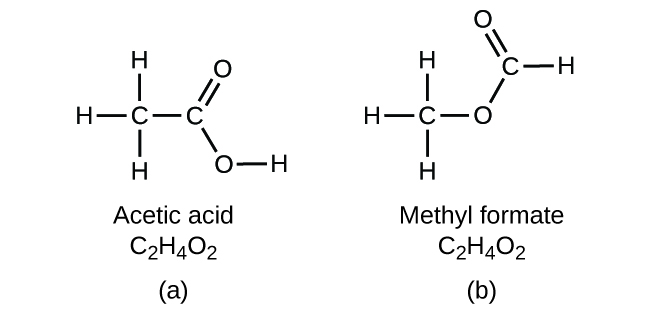
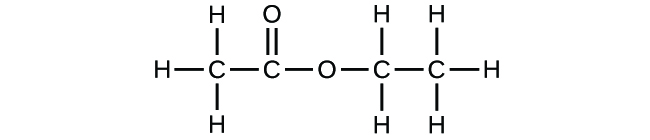
Se previr que outro composto com a fórmula C2H4O2 poderia existir, então demonstrou uma boa percepção química e está correcto. Dois átomos C, quatro átomos H, e dois átomos O também podem ser dispostos de modo a formarem um formato metílico, que é utilizado no fabrico, como insecticida, e para acabamentos de secagem rápida. As moléculas de formato metílico têm um dos átomos de oxigénio entre os dois átomos de carbono, diferente da disposição em moléculas de ácido acético. O ácido acético e o metil-formato são exemplos de isómeros-compostos com a mesma fórmula química mas com estruturas moleculares diferentes (Figura 8). Note-se que esta pequena diferença na disposição dos átomos tem um efeito importante nas suas respectivas propriedades químicas. Certamente não desejaria utilizar uma solução de formate metílico como substituto para uma solução de ácido acético (vinagre) ao fazer molhos para salada.
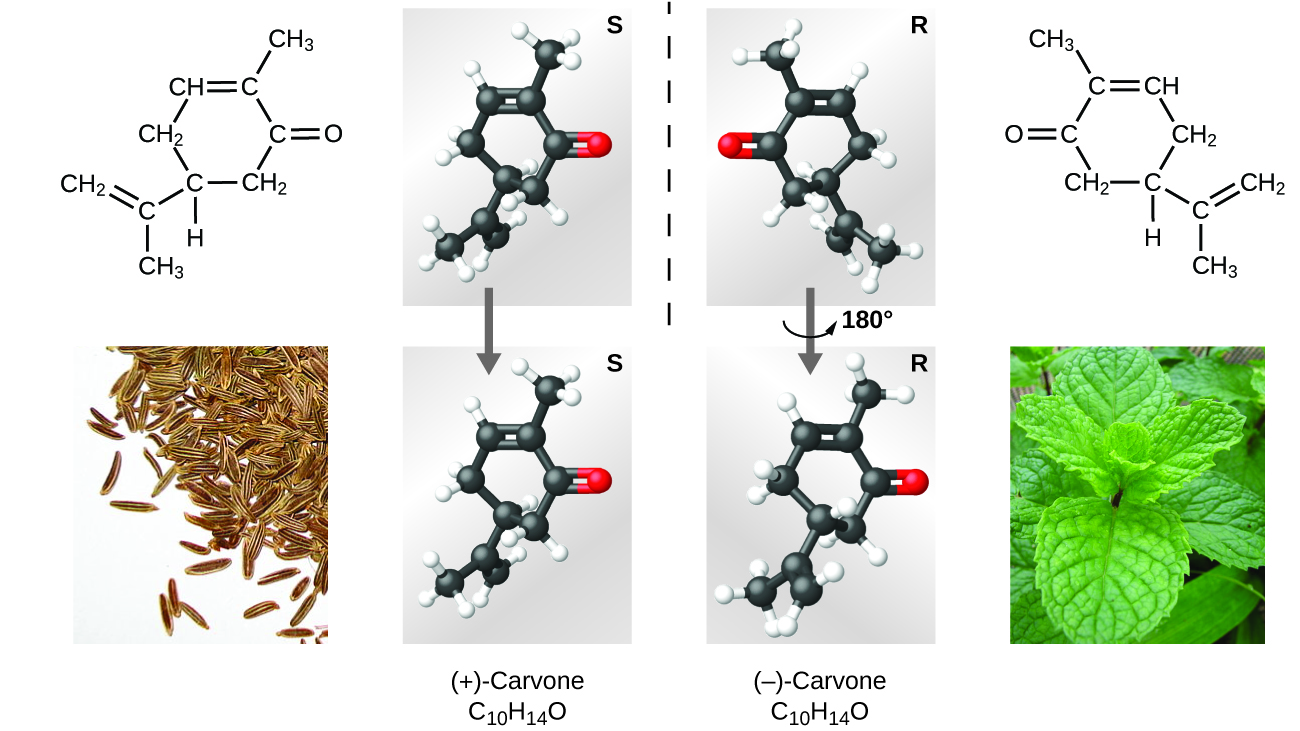
Muitos tipos de isómeros existem (Figura 9). O ácido acético e o metil-formato são isómeros estruturais, compostos em que as moléculas diferem na forma como os átomos estão ligados uns aos outros. Existem também vários tipos de isómeros espaciais, nos quais as orientações relativas dos átomos no espaço podem ser diferentes. Por exemplo, a carvona composta (encontrada em sementes de cominho, hortelã e cascas de tangerina) consiste em dois isómeros que são imagens espelhadas um do outro. S-(+)-carvone cheira a cominho, e R-(-)-carvone cheira a hortelã.
 p>Selecione este link para ver uma explicação dos isómeros, isómeros espaciais, e porque têm cheiros diferentes (seleccionar o vídeo intitulado “Mirror Molecule”): Carvone”).
p>Selecione este link para ver uma explicação dos isómeros, isómeros espaciais, e porque têm cheiros diferentes (seleccionar o vídeo intitulado “Mirror Molecule”): Carvone”). Uma fórmula molecular utiliza símbolos químicos e subscritos para indicar o número exacto de átomos diferentes numa molécula ou composto. Uma fórmula empírica dá a mais simples e completa relação de número de átomos num composto. Uma fórmula estrutural indica a disposição de ligação dos átomos na molécula. Modelos em forma de bola e de bastão e de preenchimento de espaço mostram a disposição geométrica dos átomos de uma molécula. Os isómeros são compostos com a mesma fórmula molecular mas com diferentes arranjos de átomos.
Chemistry End of Chapter Exercises
- Explicar porque é que o símbolo para um átomo do elemento oxigénio e a fórmula para uma molécula de oxigénio diferem.
- Explicar porque é que o símbolo para o elemento enxofre e a fórmula para uma molécula de enxofre diferem.
- Escreve as fórmulas molecular e empírica dos seguintes compostos:
(a)
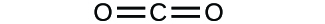
(b)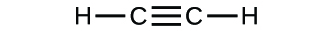
(c)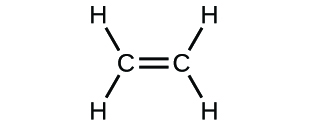
(d)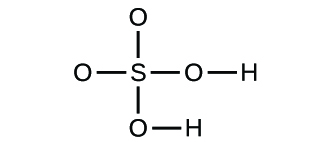
- Escreve as fórmulas molecular e empírica dos seguintes compostos:
(a)
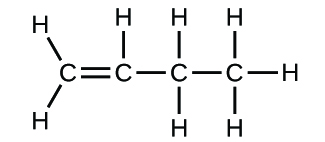
(b)
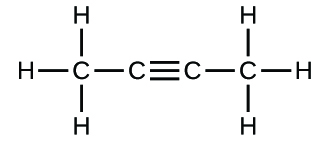
(c)
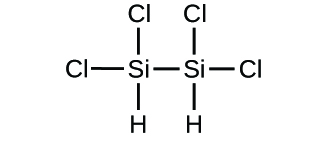
(d)
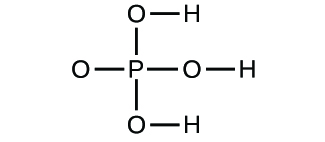
- Determinar as fórmulas empíricas para os seguintes compostos:
(a) cafeína, C8H10N4O2
(b) frutose, C12H22O11
(c) peróxido de hidrogénio, H2O2
(d) glicose, C6H12O6
(e) ácido ascórbico (vitamina C), C6H8O6
- Escrever as fórmulas empíricas para os seguintes compostos:
(a)
(b)
- Abrir a simulação de Construir uma Molécula e seleccionar o separador “Larger Molecules” (Moléculas Maiores). Seleccione um “Kit” de átomos apropriado para construir uma molécula com dois átomos de carbono e seis átomos de hidrogénio. Arraste os átomos para o espaço acima do “Kit” para fazer uma molécula. Um nome aparecerá quando tiver feito uma molécula real que existe (mesmo que não seja a que deseja). Pode usar a ferramenta da tesoura para separar átomos se quiser mudar as ligações. Clique em “3D” para ver a molécula, e olhe tanto para as possibilidades de preenchimento de espaço como para as possibilidades de bolas.
(a) Desenhe a fórmula estrutural desta molécula e indique o seu nome.
(b) Pode organizar estes átomos de alguma forma para fazer um composto diferente?
- Utilizar a simulação Construir uma molécula para repetir o Exercício 8 de Química Final do Capítulo, mas construir uma molécula com dois carbonos, seis hidrogénios e um oxigénio.
(a) Desenhar a fórmula estrutural desta molécula e indicar o seu nome.
(b) Pode arranjar estes átomos para fazer uma molécula diferente? Em caso afirmativo, desenhe a sua fórmula estrutural e indique o seu nome.
(c) Como é que as moléculas são desenhadas em (a) e (b) o mesmo? Como são diferentes? Como se chamam (o tipo de relação entre estas moléculas, não os seus nomes).
- Utilizar a simulação Construir uma Molécula para repetir Química Fim do Capítulo Exercício 8, mas construir uma molécula com três carbonos, sete hidrogénios e um cloro.
(a) Desenhar a fórmula estrutural desta molécula e indicar o seu nome.
(b) Pode organizar estes átomos para fazer uma molécula diferente? Em caso afirmativo, desenhe a sua fórmula estrutural e indique o seu nome.
(c) Como é que as moléculas são desenhadas em (a) e (b) o mesmo? Como são diferentes? Como são chamadas (o tipo de relação entre estas moléculas, não os seus nomes)?
>li>Determinar as fórmulas empíricas para os seguintes compostos:
(a) ácido acético, C2H4O2
(b) ácido cítrico, C6H8O7
(c) hidrazina, N2H4
(d) nicotina, C10H14N2
(e) butano, C4H10
Glossary
fórmula empírica mostrando a composição de um composto dado como a mais simples relação de número inteiro de átomos isómeros compostos com a mesma fórmula química mas com estruturas diferentes fórmula molecular indicando a composição de uma molécula de um composto e dando o número real de átomos de cada elemento de uma molécula do composto. isómeros espaciais compostos em que as orientações relativas dos átomos no espaço diferem em fórmula estrutural mostra os átomos de uma molécula e como estão ligados isómero estrutural uma de duas substâncias que têm a mesma fórmula molecular mas propriedades físicas e químicas diferentes porque os seus átomos estão ligados de forma diferente
Soluções
Respostas a Exercícios de Fim de Capítulo de Química
1. O símbolo para o elemento oxigénio, O, representa tanto o elemento como um átomo de oxigénio. Uma molécula de oxigénio, O2, contém dois átomos de oxigénio; o subscrito 2 na fórmula deve ser utilizado para distinguir a molécula diatómica de dois átomos únicos de oxigénio.
3. (a) CO2 molecular, CO2 empírico; (b) C2H2 molecular, CH empírico; (c) C2H4 molecular, CH2 empírico; (d) H2SO4 molecular, H2SO4 empírico
5. (a) C4H5N2O; (b) C12H22O11; (c) HO; (d) CH2O; (e) C3H4O3
7. (a) CH2O; (b) C2H4O
9. (a) etanol
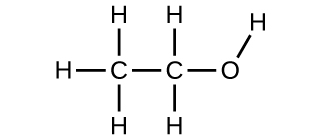
(b) metóxido de metano, mais comummente conhecido como éter dimetílico
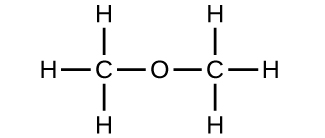
(c) Estas moléculas têm a mesma composição química (tipos e número de átomos) mas estruturas químicas diferentes. São isómeros estruturais.
- Lee Cronin, “Print Your Own Medicine”, Palestra apresentada na TED Global 2012, Edimburgo, Escócia, Junho de 2012. ↵