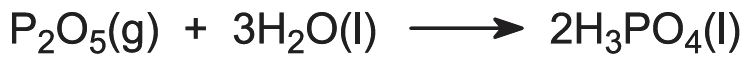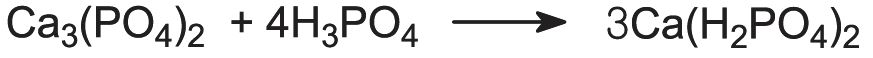Usos de ácido fosfórico
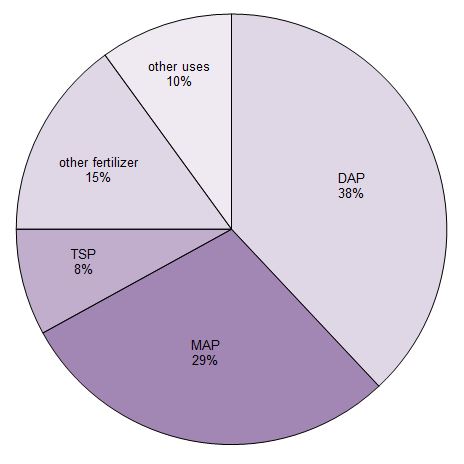
Sobre 90% do ácido fosfórico produzido é utilizado para fazer fertilizantes. É principalmente convertido em três sais fosfóricos que são utilizados como fertilizantes. São superfosfato triplo (TSP), hidrogéniofosfato diamónico (DAP) e dihidrogenofosfato monoamónico (MAP).
Figure 1 Usos de ácido fosfórico.
Dados da Potash Corporation, 2014
Fosfatos são também utilizados de várias outras formas, incluindo em refrigerantes e como suplemento em alimentos dados a bovinos, suínos e aves de capoeira.
Embora a sua utilização como construtores em detergentes tenha sido gradualmente eliminada em muitos países, ainda é uma utilização importante para o ácido em alguns países.
Produção anual de ácido fosfórico
| World | 43 milhões de toneladas1,2,3 |
| China | 17 milhões de toneladas4 |
| Sudeste e Norte-Ásia Oriental (incluindo Indonésia e Japão) |
10 milhões de toneladas4 |
| US | 8.4 milhões de toneladas5 |
1 Potash Corporation, 2014
2 JDCPhosphate, 2014
3 Estimativa para 2016
4 Extrapolado a partir de dados, IHS,Markit, 2015
5 2015 Business of Chemistry, American Chemistry Council, 2016
Fabricação de ácido fosfórico
O ácido fosfórico é feito por dois processos:
a) o processo “húmido”
b) processo térmico
O método térmico produz normalmente um produto mais concentrado e mais puro, mas é energeticamente intensivo (por causa do fabrico do próprio fósforo. O ácido produzido por via ‘húmida’ é menos puro mas é utilizado no fabrico de fertilizantes.
(a) Processo húmido
Ácido fosfórico é produzido a partir de fluorapatite, conhecida como rocha fosfática, 3Ca3(PO4)2.CaF2, pela adição de ácido sulfúrico concentrado (93%) numa série de reactores bem agitados. Isto resulta em ácido fosfórico e sulfato de cálcio (gipsita) mais outras impurezas insolúveis. Adiciona-se água e o gesso é removido por filtração juntamente com outros materiais insolúveis (por exemplo, sílica). O flúor, como o H2SiF6, é removido numa fase posterior por evaporação.
Embora a reacção ocorra em fases envolvendo o di-hidrogenofosfato de cálcio, a reacção global pode ser representada como:
No entanto, há reacções laterais; por exemplo com fluoreto de cálcio e carbonato de cálcio presentes na rocha:


Ácido fluorossilicílico é um subproduto importante deste e do fabrico de fluoreto de hidrogénio. Pode ser neutralizado com hidróxido de sódio para formar hexafluorosilicilicato de sódio. O ácido é também utilizado para fazer fluoreto de alumínio, utilizado por sua vez no fabrico de alumínio.
A estrutura cristalina do sulfato de cálcio formado depende das condições da reacção. A 340-350 K, o produto principal é o dihidrato, CaSO4.2H2O. A 360-380 K, o hemihidrato é produzido, CaSO4.1/2H2O.
Sulfato de cálcio é filtrado e o ácido é então concentrado a cerca de 56% P2O5 utilizando destilação a vácuo.
O produto do ácido do “processo húmido” é impuro mas pode ser utilizado, sem purificação adicional, para o fabrico de fertilizantes (ver abaixo). Em alternativa, pode ser evaporado até cerca de 70% de P2O5, uma solução chamada ácido superfosfórico que é utilizada directamente como fertrilizador líquido.
Para fazer fosfatos industriais, o ácido é purificado por extracção com solvente utilizando, por exemplo, metilisobutilcetona (MIBK) na qual o ácido é ligeiramente solúvel e concentrado para dar 60% de P2O5. Este ácido pode ser ainda purificado utilizando solventes para o extrair de metais pesados e desfluorado (por evaporação) para produzir um produto de qualidade alimentar.
(b) Processo térmico
As matérias-primas para este processo são fósforo e ar:
Inicialmente, o fósforo é pulverizado no forno e queimado no ar a cerca de 1800-3000 K.
P>A maior parte dos processos utiliza ar não seco e muitos envolvem a adição de vapor ao queimador de fósforo para produzir e manter uma película de ácidos polifosfóricos condensados que protegem a torre do queimador de aço inoxidável (arrefecido externamente com água). Os produtos da torre do queimador passam directamente para uma torre de hidratação onde o óxido de fósforo gasoso é absorvido em ácido fosfórico reciclado:
Alternativamente, o fósforo pode ser queimado em ar seco. O pentóxido de fósforo é condensado como pó branco e hidratado separadamente em ácido fosfórico.
Este método permite recuperar o calor e reutilizá-lo.
queimadura e hidratação directa, como descrito anteriormente, cria condições altamente corrosivas. O equipamento é construído em aço inoxidável ou é revestido com tijolo de carbono. Para reduzir a corrosão, as paredes do queimador e das torres de hidratação são arrefecidas, mas os produtos do reactor emergem a uma temperatura demasiado baixa para a recuperação útil de calor.
O produto ácido tem uma concentração de cerca de 85%.
Ácido tetrafosfórico, um de uma família de ácidos polifosfóricos que pode ser produzido selectivamente, é feito quer fervendo água a altas temperaturas num recipiente de carbono, quer adicionando pentóxido de fósforo sólido a ácido fosfórico quase em ebulição. O primeiro método dá geralmente o produto mais puro, devido ao elevado teor de arsénico do pentóxido de fósforo.
Fosfatos
Os sais do ácido fosfórico, os fosfatos, são os compostos amplamente utilizados na agricultura, na indústria e no lar.
(a) Fosfatos de amónio
Di-hidrogenofosfato de monoamónio e hidrogenofosfato de diamónio são muito utilizados como fertilizantes e são feitos misturando as proporções correctas de ácido fosfórico com amoníaco anidro num tambor rotativo.
A escolha do fosfato de amónio a utilizar depende da proporção de azoto e fósforo necessária para a cultura.
(b) Fosfatos de cálcio
Os fosfatos de cálcio são amplamente utilizados como fertilizantes. O dihidrogenofosfato de cálcio, Ca(H2PO4)2, é produzido pela reacção de rocha fosfática com ácido sulfúrico:
Este é conhecido como superfosfato. Contém cerca de 20% de P2O5.
Se a rocha fosfática for tratada com ácido fosfórico, em vez de ácido sulfúrico, é produzida uma forma mais concentrada de dihidrogenofosfato de cálcio com um nível global mais elevado de P2O5 (50%):
Este é conhecido como superfosfato triplo. O nível mais elevado de fosfato é alcançado porque o produto já não é diluído com sulfato de cálcio.
(c) Fosfatos de sódio
Fosfatos de sódio são produzidos por reacção de ácido fosfórico e uma solução concentrada de hidróxido de sódio nas proporções apropriadas (estequiométricas). O produto cristaliza.
- Di-hidrogenofosfato monossódico (MSP, NaH2PO4) é utilizado na limpeza de metais e formulações de preparação de superfícies, como fonte de fosfato na fabricação farmacêutica, e como agente de controlo de pH em pastas de dentes, em revestimento de esmalte vítreo (artigos sanitários) e na fabricação de fosfatos de amido. Uma das maiores utilizações é como tratamento de plumbosolvência em água potável. O ácido fosfórico ou MSP pode ser utilizado para produzir um revestimento fino e insolúvel de fosfato de chumbo em tubos de chumbo para evitar a dissolução do chumbo pelos ácidos na água.
- Hidrogenofosfato dissódico (Na2HPO4) é utilizado como agente amaciador em queijo processado, em esmaltes e esmaltes cerâmicos, em curtumes de couro, no fabrico de corantes e como inibidor de corrosão no tratamento de água.
- Fosfato trissódico (Na3PO4) é utilizado em produtos de limpeza de alta resistência, por exemplo, em aço desengordurado. É um alcalino e um sequestrante para iões de cálcio, mantendo-os em solução e evitando a formação de escória.
- O pirofosfato dissódico (Na2H2P2O7) é utilizado como agente levedante em pão/bolos (ajuda à libertação de dióxido de carbono do bicarbonato de sódio), como supressor de óxido de ferro (efeito escurecimento ou acastanhamento) no fabrico de vários alimentos e como dispersante em lama de perfuração de poços de petróleo.