Objectivos de aprendizagem
- Determinar a susceptibilidade de várias espécies bacterianas a vários antibióticos e agentes sintéticos.
Um verdadeiro antibiótico é um químico antimicrobiano produzido por microrganismos contra outros microrganismos. A humanidade tem feito muito bom uso destes antimicrobianos na sua luta contra doenças infecciosas. Muitos medicamentos são agora completamente sintéticos ou o medicamento natural é manipulado para alterar um pouco a sua estrutura, este último chamado semissintético. As bactérias respondem de formas diferentes aos antibióticos e às drogas quimiossintéticas, mesmo dentro da mesma espécie. Por exemplo, Staphylococcus aureus é uma bactéria comum da flora normal encontrada no corpo. Se se isolasse esta bactéria de 5 pessoas diferentes, os 5 isolados seriam provavelmente estirpes diferentes, ou seja, ligeiramente diferentes geneticamente. É também provável que se fossem efectuados testes de sensibilidade aos antibióticos nestes isolados, os resultados variariam em relação aos diferentes antibióticos utilizados.
O teste Kirby-Bauer de susceptibilidade aos antibióticos (também chamado teste de difusão em disco) é um padrão que tem sido utilizado durante anos. Desenvolvido pela primeira vez nos anos 50, foi aperfeiçoado e por W. Kirby e A. Bauer, depois padronizado pela Organização Mundial de Saúde em 1961. Foi substituído em laboratórios clínicos por testes automatizados. Contudo, o K-B ainda é utilizado em alguns laboratórios, ou utilizado com certas bactérias com as quais a automatização não funciona bem. Este teste é utilizado para determinar a resistência ou sensibilidade de aerobes ou anaerobes facultativos a produtos químicos específicos, que podem então ser utilizados pelo clínico para tratamento de pacientes com infecções bacterianas. A presença ou ausência de uma área inibitória em redor do disco identifica a sensibilidade bacteriana ao medicamento (Figura \PageIndex{1}}).
O básico é fácil: a bactéria é esfregada no ágar e os discos antibióticos são colocados no topo. O antibiótico difunde-se do disco para o ágar em quantidades decrescentes, quanto mais longe estiver do disco. Se o organismo for morto ou inibido pela concentração do antibiótico, não haverá crescimento na área imediata em redor do disco: Esta é chamada a zona de inibição (Figura 9.1). Os tamanhos da zona são procurados numa tabela padronizada para dar um resultado sensível, resistente, ou intermédio. Muitos gráficos têm uma coluna correspondente que também dá o MIC (concentração inibitória mínima) para esse fármaco. O MIC é actualmente o teste padrão para testes de sensibilidade aos antibióticos porque produz informação mais pertinente sobre dosagens mínimas.
O meio Mueller-Hinton utilizado para o teste Kirby-Bauer é muito elevado em proteínas.
NECESSIDADE DE MATERIAIS: por tabela
- 2 placas de ágar Mueller-Hinton
- 24 hr de culturas antigas (provavelmente de Staph, E. coli, Bacillus subtilus, Enterococcus fecalis) esfregaços esterilizados
- tabela de directrizes para interpretação da susceptibilidade aos antibióticos
li>antibióticosli>etanolli>forcepsli> Pseudomonas aeruginosa Kirby-Placa de Bauer para demonstração
THE PROCEDIMENTOS
2ª cobertura de zaragatoa ►

- Swab a Mueller-Placa Hinton com SOMENTE 2 das bactérias (as tabelas farão funcionar diferentes combinações das 4 bactérias). Mergulhar uma zaragatoa esterilizada no caldo e exprimir qualquer excesso de humidade pressionando a zaragatoa contra o lado do tubo.
- Após esfregar completamente a placa, rodá-la a 90 graus e repetir o processo de esfregaço. (Não é necessário voltar a humedecer a zaragatoa.) Fazer correr a zaragatoa à volta da circunferência da placa antes de a descartar no saco de descarte.
- Permitir que a superfície seque durante cerca de 5 minutos antes de colocar os discos de antibióticos sobre o ágar.
- O DISCO ANTIBIÓTICO:
li>Swab a superfície do ágar completamente (não se quer deixar nenhuma zona de ágar inabalável). Nas imagens abaixo, pode-se ver o que acontece quando a placa não é esfregada correctamente com cobertura uniforme da bactéria sobre todo o ágar.
- >li>Você está a usar dispensadores individuais de antibióticos.
-
 Terá provavelmente de usar um par de pinças para remover um disco de antibiótico do dispensador: a pinça tem de ser esterilizada. Coloque o fórceps em álcool, acenda a chama do fórceps até que pegue fogo, deixe a chama apagar-se—-sterile forceps.
Terá provavelmente de usar um par de pinças para remover um disco de antibiótico do dispensador: a pinça tem de ser esterilizada. Coloque o fórceps em álcool, acenda a chama do fórceps até que pegue fogo, deixe a chama apagar-se—-sterile forceps.
Li>Tocalize levemente cada disco com o seu laço inoculante estéril para se certificar de que está em bom contacto com a superfície do ágar. Incubar de cabeça para baixo e incubar a 37o C.
INTERPRETATION
-
 Coloque a régua métrica ao longo da zona de inibição, no diâmetro mais largo, e meça de uma borda da zona para a outra borda. ACOMPANHAR A Régua métrica até à AJUDA LEVE.
Coloque a régua métrica ao longo da zona de inibição, no diâmetro mais largo, e meça de uma borda da zona para a outra borda. ACOMPANHAR A Régua métrica até à AJUDA LEVE. - Medições milimétricas de utilização. O diâmetro do disco fará realmente parte desse número.
- Se não houver nenhuma zona, reporta-o como 0— embora o disco em si seja cerca de 7 mm.
- Diâmetro da zona é reportado em milímetros, visto no gráfico, e o resultado reportado como sensível, resistente, ou intermédio.
- Recorde os resultados da sua tabela, bem como de outras tabelas, na tabela.
|
Antibiótico (Agente Antimicrobiano) |
DISC CODE |
Resistente (< ou = mm) |
Intermediário (mm) |
Susceptível (= ou > mm) |
|
|---|---|---|---|---|---|
| Amoxicillin (other) | AMC | <13 | 14-17 | mm)” style=”text-alinhar:centro;” class=”lt-bio-3483″>>18 | |
| Amoxicilina (Staph) | AMC | 19 | mm)” style=”text-alinhar:centro;” class=”lt-bio-3483″>20 | ||
| Ampicillin (other) | AM | 11 | 12-13 | mm)” style=”text-alinhar:centro;” class=”lt-bio-3483″>14 | |
| Ampicillin (Staph) | AM | 28 | mm)” style=”text-alinhar:centro;” class=”lt-bio-3483″>29 | ||
| Carbenicilina (outros) | CB | 17 | 18- | 17 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>23 |
| Carbenicilina (Pseudomonas) | CB | 13 | 14-16 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>17 | |
| Cefoxitin | FOX | 14 | 15-.17 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>18 | |
| Cephalothin | CF | 14 | 15-.17 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>18 | |
| Cloranfenicol | C | 12 | 13-17 | mm)” style=”text-align:centro;”class=”lt-bio-3483″>18 | |
| Ciprofloxacin | CIP-5 | 15 | 16-20 | mm)” style=”text-align:centro;”class=”lt-bio-3483″>21 | |
| Clindamicina | CC-2 | 14 | 15-20 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>21 | |
| Enoxacin (Fluoroquinolona, 2ª geração.) | ENX-10 | 14 | 15-17 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>18 | |
| Erthromycin | E | 13 | 14-.22 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>23 | |
| Gentamycin | GM | 12 | 13-.14 | mm)” style=”text-align:centro;”class=”lt-bio-3483″>15 | |
| Kanamycin | K-30 | 13 | 14-17 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>18 | |
| Methicillin (Staph) | M(orDP) | 9 | 10-13 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>14 | |
| Oxacillin (Staph) | OX | 10 | 11-12 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>13 | |
| Penicillin G (Enterococcus) | P | 14 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>15 | ||
| Penicillin G (Staph) | P | 28 | mm)” style=”text-align:centro;”class=”lt-bio-3483″>29 | ||
| Streptomicina | S-10 | 14 | 15-20 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>21 | |
| Sulfamethoxazole-trimethoprim | SXT | 10 | 11-15 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>16 | |
| Tetracycline | Te-…30 | 14 | 15-18 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>19 | |
| Tobramycin | NN-.10 | 12 | 13-14 | mm)” style=”text-align:centro;”class=”lt-bio-3483″>15 | |
| Vancomycin | Va-30 | 9 | 10-11 | mm)” style=”text-align:center;”class=”lt-bio-3483″>12 |
TABLE FOR RESULTS
Recordar os resultados para as 5 bactérias com todos os antibióticos.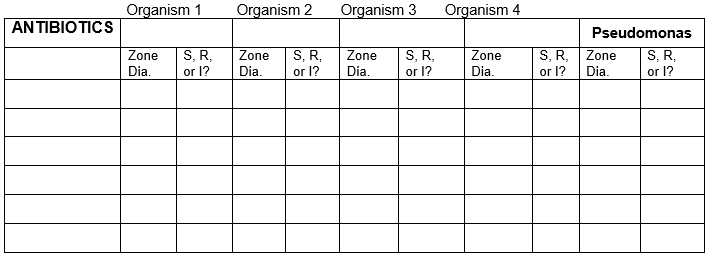
diâmetro da zona em unidades milimétricas. Usar gráfico para sensível, resistente, ou intermédio
QUESTIONS
- Quanto maior for o tamanho da zona, mais ____________ a bactéria é para aquele antibiótico.
- Que unidades de medida são usadas para medir o tamanho da zona?
- Como se compara a sensibilidade do Staph com a sensibilidade do Pseudomonas?
Contribuintes
- p>Jackie Reynolds, Professor de Biologia (Richland College)