Ligação Covalente Única
A ligação covalente mais simples é formada entre dois átomos de hidrogénio. Cada átomo de hidrogénio tem um único electrão, e cada um necessita de dois electrões para uma cobertura exterior completa. A molécula de hidrogénio, {H_2}}, consiste em dois átomos de hidrogénio que partilham os seus dois electrões de valência. O hidrogénio também pode formar ligações covalentes com outros átomos. Por exemplo, o hidrogénio e o cloro precisam cada um de mais um electrão para alcançar uma configuração de gás nobre. Partilhando electrões de valência (cada átomo doa um), forma-se a molécula estável {HCl}}.
Usaremos uma representação simplificada de ligações covalentes conhecidas como estruturas Lewis. Estes desenhos são também conhecidos por vários outros nomes, incluindo estruturas de pontos Lewis ou estruturas de pontos electrónicos. Cada ponto na estrutura representa um electrão de valência no composto. Por exemplo, {H_2} poderia ser desenhado como {H_ce{H} : {H_ce{H}). Cada ponto representa um electrão de valência, e o facto de serem colocados entre os dois átomos significa que estão a ser partilhados com base numa ligação covalente. Para moléculas maiores, pode tornar-se incómodo extrair todos os electrões de valência, pelo que um par de electrões de ligação também pode ser desenhado como uma linha recta. Assim, também pode ser representado como uma linha recta.
Se quiséssemos mostrar a estrutura Lewis de {HCl}, desenharíamos o seguinte:

Podemos ver que a ligação covalente consiste em dois electrões entre o {H-ce{H} e o {H-ce{Cl}). O cloro tem uma concha exterior completa de dois electrões e o cloro tem uma concha exterior completa de oito electrões. Podem ser escritas ligações covalentes com outros halogéneos da mesma forma.
Tipos semelhantes de estruturas Lewis podem ser escritas para outras moléculas que formam ligações covalentes. Muitos compostos que contêm ligações covalentes são mantidos juntos por ligações covalentes. O número de ligações covalentes que um átomo irá formar pode geralmente ser previsto pelo número de electrões que um átomo necessita para preencher a sua casca de valência. Por exemplo, o oxigénio tem 6 electrões na sua casca exterior e precisa de mais dois para preencher esta casca, pelo que apenas formará duas ligações covalentes com outros átomos. Se olharmos para a molécula da água (esquerda( {H_2O} direita)}) (ver figura abaixo), vemos que o átomo de oxigénio faz duas ligações totais (uma com cada átomo de hidrogénio).
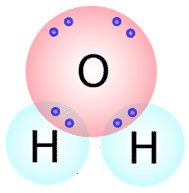
Como pode ver, existem dois pares de electrões não envolvidos na ligação covalente. Estes pares de electrões não ligados são conhecidos como pares solitários e contribuem para a forma geral da molécula. Da mesma forma, o azoto necessita de três electrões para completar a sua casca de valência, pelo que tende a fazer três ligações covalentes, com um par solitário de electrões sem ligação que sobra.
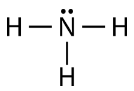
Again, cada uma das linhas representa um par de electrões de ligação (uma única ligação), e o par solitário de azoto é desenhado como dois pontos.