Gebruik onze NMR service die 1H NMR en vele andere NMR technieken biedt.
Er zijn drie isotopen van waterstof die in NMR spectroscopie worden gebruikt: 1Hydrogen, 2Deuterium en 3Tritium. Elke isotoop resoneert op een heel andere frequentie, bijvoorbeeld als 1H resoneert op 400 MHz, dan resoneert 2H op 61,402 MHz. Er wordt slechts één isotoop tegelijk waargenomen omdat de spectrometer zendt en ontvangt over een zeer beperkt frequentiebereik. De chemische verschuivingsbereiken voor de drie kernen zijn vrijwel identiek en kunnen worden gebruikt voor voorlopige analyse, maar daar houdt de overeenkomst op. 3Tritium wordt niet vaak met NMR gemeten omdat het radioactief is.
Elk type signaal heeft een karakteristiek chemisch verschuivingsbereik (fig. 1) dat voor een eerste toewijzing kan worden gebruikt.
Fig. 1. Chemische verschuivingsbereiken van protonen volgens hun chemische omgeving
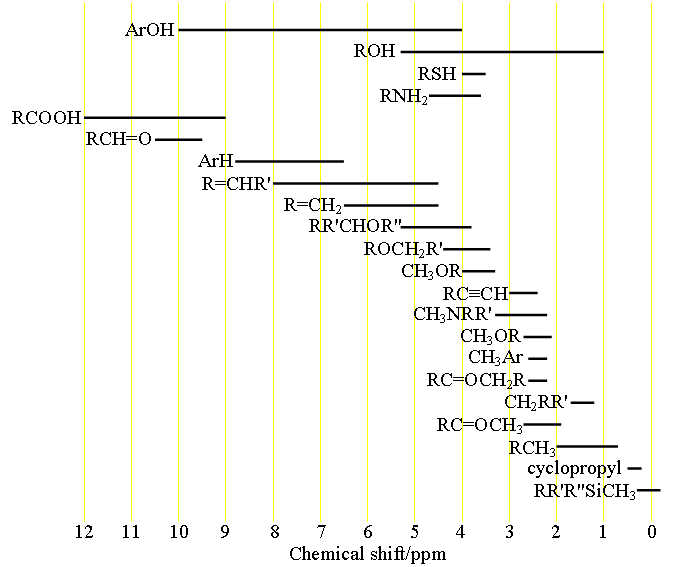
Kies de structuur die het meest overeenkomt met de waterstof in kwestie. R = alkyl of H, Ar = aryl.
1Hydrogen (Proton) NMR
Het 1D 1H (Proton) NMR-experiment is het meest voorkomende NMR-experiment. Het proton (1Hydrogen nucleus) is de gevoeligste nucleus (afgezien van tritium) en geeft meestal scherpe signalen. Hoewel het bereik van de chemische verschuiving smal is, maken de scherpe signalen proton NMR zeer nuttig. Onze NMR dienst biedt proton NMR samen met vele andere NMR technieken.
Een typische analyse van een 1H NMR spectrum kan als volgt verlopen:
Het aantal protonen van elk type in het spectrum van een zuiver monster kan direct worden verkregen uit de integralen van elk multiplet. Dit is alleen waar als de multiplets goed gescheiden zijn en niet overlappen met de oplosmiddel- of restwatersignalen en op voorwaarde dat het molecuul geen langzame conformatie-uitwisseling ondergaat. Een routine NMR spectrum geeft integralen met een nauwkeurigheid van +/-10%. Nauwkeurigheden van +/-1% kunnen worden bereikt door de relaxatievertraging te verhogen tot vijf maal de longitudinale relaxatietijd (T1) van de signalen van belang. Wanneer multiplets elkaar overlappen, kan de totale integraal van het spectrale gebied worden gebruikt.
Uit de tabel van de chemische verschuivingen van de protonen verkrijgt men informatie over elk type proton en kan men een voorlopige toewijzing uitvoeren.
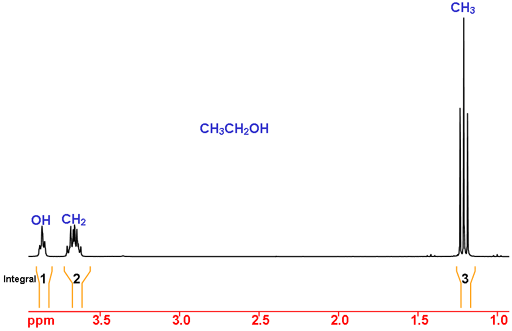
Overweeg ethanol als voorbeeld (Fig. 2). Met behulp van chemische verschuivingen ligt de piek bij 1,2 ppm in het verwachte bereik voor CH3 (methyl) en bij 3,7 en 3,9 ppm zijn compatibel met CH2 (methyleen). De chemische verschuiving van OH is sterk afhankelijk van het oplosmiddel en andere experimentele omstandigheden en kan dus niet alleen met behulp van de chemische verschuiving worden bepaald.
Met behulp van integratie verwachten we dat CH3 een integraal van drie heeft, CH2 een integraal van twee en OH een integraal van één. Dit is het geval en dus is de toewijzing compleet.
Fig. 2. 1H NMR spectrum van ethanol in CDCl3
Voor andere moleculen is dit niet voldoende en is de multiplet-structuur nodig om de toewijzing compleet te maken. De multiplets (fig. 3) ontstaan door spin-spin koppelingen die door chemische bindingen worden doorgegeven en geven informatie over de directe moleculaire omgeving. In het geval van CH3 en OH worden zij gesplitst door de twee naburige protonen van de CH2 om een tripletpatroon te verkrijgen dat AX2 wordt genoemd. (Klik hier voor een lijst van homonucleaire splitspatronen en een beschrijving van heteronucleaire koppeling). Het CH2 wordt gesplitst door het enkele OH proton en de drie CH3 protonen om het AX3Y patroon te vormen. (Klik hier voor verdere voorbeelden van spectrale toewijzing, 2D toewijzing van 12,14-ditbutylbenzochryseen en 2D toewijzing van cholesterylacetaat.)
Fig. 3. Multipletstructuren uit het 1H NMR-spectrum van ethanol in CDCl3
Na bepaling van de multipliciteit kan men de koppelingsconstanten meten. Deze worden gemeten in Hz (niet ppm), omdat ze veldonafhankelijk zijn. Als twee (en slechts twee) multiplets dezelfde koppelingsconstante hebben, weet je dat ze afkomstig zijn van nabijgelegen protonen. De koppelingsconstante geeft een indicatie van de afstand tussen de protonen. In het algemeen betekent 10 tot 18 Hz een twee- of driebandige trans naar een C=C-dubbele binding. Koppelingsconstanten tussen 1 en 10 Hz wijzen op drie bindingen of meer bindingen indien gedelokaliseerd. Minder dan 1 Hz betekent meestal vier of meer bindingen.
Naast homonucleaire koppelingen kunnen de multiplets worden gesplitst door andere kernen, zoals 19Fluor of 31Fosfor. (Als dergelijke heteronucleaire koppelingen ongewenst zijn, kunnen ze worden ontkoppeld. De beste pulssequentie in zo’n geval is die voor inverse gated ontkoppeling.)
Eigenschappen van 1H
(Klik hier voor uitleg)
| Eigenschap | Waarde |
|---|---|
| Spin | ½ |
| Natuurlijke overvloed | 99.9845% |
| Chemical shift range | 13 ppm, van -1 tot 12 |
| Frequentieverhouding (Ξ) | 100.000000% |
| TMS < 1% in CDCl3 = 0 ppm | |
| Lijnbreedte van referentie | 0.08 Hz |
| T1 van referentie | 14 s |
| Receptiviteit t.o.v. 1H bij natuurlijke abundantie | 1.000 |
| 1.000 | |
| Receptiviteit t.o.v. 13C bij natuurlijke abundantie | 1.000 |
| 5870 | |
| Receptiviteit rel. tot 13C bij verrijking | 5871 |
2Deuterium NMR
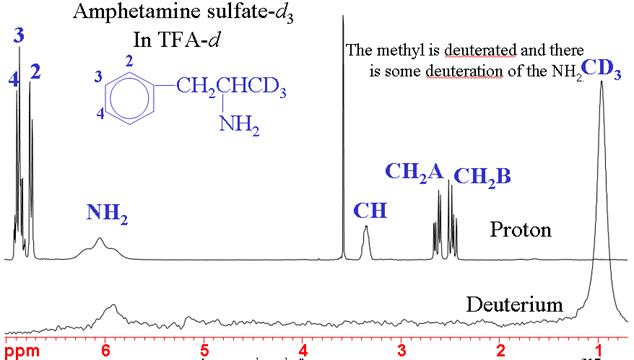
2Deuterium (zware waterstof) NMR wordt gewoonlijk gebruikt voor veldfrequentievergrendeling. Bij natuurlijke abundantie heeft het een zeer lage gevoeligheid, maar wanneer het verrijkt is, heeft het een gemiddelde gevoeligheid. Deuterium geeft meestal brede signalen waarvan de lijnbreedte typisch varieert tussen een paar hertz en een paar kilohertz. Het spectrum heeft hetzelfde smalle chemische verschuivingsbereik als voor 1H, maar de lage resolutie en lagere gevoeligheid maken het een slecht alternatief. Deuterium-deuterium-koppelingen zijn ongeveer 40 maal kleiner dan proton-proton-koppelingen en worden daarom niet waargenomen. In gedeeltelijk gedeuterateerde moleculen kunnen echter kleine proton-deuteriumkoppelingen worden waargenomen. Het belangrijkste gebruik van deuterium spectra is voor het bepalen van de effectiviteit van chemische deuteratie (fig. 4).
Fig. 4. 1H- en 2H NMR-spectra van amfetaminesulfaat-d3 met succesvolle specifieke deuteratie van de methyl-
Eigenschappen van 2H
(Klik hier voor uitleg)
| Eigenschap | Waarde |
|---|---|
| Spin | 1 |
| Natuurlijke abundantie | 0.0155% |
| Chemical shift range | 13 ppm, van -1 tot 12 |
| Frequentieverhouding (Ξ) | 15.350609% |
| Referentieverbinding | TMS-d12 netjes = 0 ppm |
| Lijnbreedte van referentie | 1.7 Hz |
| T1 van referentie | 1 s |
| Receptiviteit t.o.v. 1H bij natuurlijke abundantie | 1.50 × 10-6 |
| Receptiviteit t.o.v. 1H bij verrijking | 9.65 × 10-3 |
| Receptiviteit t.o.v. 13C bij natuurlijke abundantie | 8,78 × 10-3 |
| Receptiviteit t.o.v. 13C bij verrijking | 56.7 |
| Lijnbreedteparameter | 0,41 fm4 |
3Tritium NMR
3T is de enige kern die gevoeliger is dan het proton (1H). Omdat het een spin-½ isotoop van waterstof is, lijken spectra van volledig getrititiseerde verbindingen op die van 1H, met in feite dezelfde chemische verschuivingen, maar met een iets hogere gevoeligheid, dispersie en koppelingsconstanten. 3T is echter zeer radioactief, zodat de meeste NMR studies worden uitgevoerd met gedeeltelijk en specifiek gemerkte verbindingen.
Ons laboratorium beschikt niet over de apparatuur om tritium te hanteren of tritium NMR spectra te verkrijgen. We zijn echter bereid om de logistiek te bespreken als er vraag is naar deze dienst.
Eigenschappen van 3H
(Klik hier voor uitleg)
| Eigenschap | Waarde |
|---|---|
| Spin | ½ |
| Natuurlijke abundantie | 0.00000000000003% |
| Chemical shift range | 13 ppm, van -1 tot 12 |
| Frequentieverhouding (Ξ) | 106.663974% |
| Referentieverbinding | TMS-t1 < 1% in CDCl3 = 0 ppm |
| Lijnbreedte van referentie | ~0.1 Hz |
| T1 van referentie | ~20 s |
| Receptiviteit t.o.v. 1H bij natuurlijke abundantie | 4 × 10-18 |
| Receptiviteit t.o.v. 1H bij verrijking | Receptiviteit t.o.v. tot 1H bij verrijking | 1.21 |
| Receptiviteit rel. tot 13C bij natuurlijke abundantie | 2 × 10-14 |
| Receptiviteit rel. voor 13C bij verrijking | 7103 |
Veiligheidsaanwijzing:
Enkele van de hier genoemde materialen zijn zeer gevaarlijk. Vraag een gekwalificeerde chemicus om advies voordat u ze hanteert. Gekwalificeerde scheikundigen moeten de relevante veiligheidsliteratuur raadplegen alvorens onbekende stoffen te hanteren of hierover advies te geven. NMR oplosmiddelen zijn giftig en de meeste zijn ontvlambaar. Met name TMS is giftig, vluchtig en ontvlambaar: draag beschermende handschoenen en werk in een zuurkast. Alle geuteriseerde verbindingen zijn giftig. Tritium is radioactief: zorg ervoor dat u over de nodige deskundigheid en uitrusting beschikt alvorens het te hanteren.