Waarom verbinden atomen zich met elkaar?
Atomen verbinden zich met elkaar, zodat ze hun energie kunnen verlagen en stabiel worden. En als atomen zich binden met andere atomen, maken ze vaak moleculen met unieke chemische en fysische eigenschappen. Laten we het onderstaande model gebruiken om uit te leggen hoe atomen zich binden om stabiel te worden.
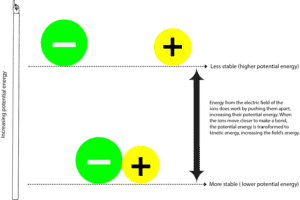
Wanneer het negatief geladen atoom (anion) en het positief geladen atoom (kation) een binding vormen, zijn ze meestal stabieler met een lagere potentiële energie. Potentiële energie is de energie als gevolg van de relatieve posities van deze ionen in het hen omringende elektrische veld. Een elektrisch veld is een gebied waarin zich een kracht uitoefent. In sommige opzichten is een elektrisch veld vergelijkbaar met een magnetisch veld. En je kunt deze krachtlijnen rond een magnetisch veld zien als je er ijzervijlsel omheen spreidt.
Om het negatieve ion van het positieve ion te scheiden, moet het elektrische veld dat de ionen omgeeft, werk verrichten door deze ionen uit elkaar te trekken. Terwijl het elektrische veld dit doet, draagt het ook energie over aan deze deeltjes, waardoor hun potentiële energie toeneemt. Je kunt dit proces vergelijken met het trekken aan twee magneten die zich tot elkaar aangetrokken voelen. In dit geval ben jij het krachtveld dat de energie levert om ze uit elkaar te trekken, en terwijl jij ze uit elkaar trekt, vergroten de magneten hun potentiële energie. En omdat ze meer moeite moeten doen om uit elkaars buurt te blijven, worden ze onstabiel. Zodra je ze loslaat, worden de twee magneten snel tot elkaar aangetrokken, waardoor hun potentiële energie afneemt.
Waar is de rest van de potentiële energie gebleven?
Die energie is aan jou en de omgeving teruggegeven in de vorm van kinetische energie. Kinetische energie is de energie die een voorwerp heeft als het beweegt, en we voelen deze energie vaak als warmte. Telkens als je warmte voelt, betekent dat dus dat energie van een hetere plaats naar een koudere plaats gaat. Of anders gezegd, van een meer geconcentreerde naar een minder geconcentreerde bron. Bedenk wel dat energie nooit andersom kan worden overgedragen – van een koudere naar een hetere plaats.
Dus als energie wordt overgedragen van en terug naar het veld of van en terug naar het heelal, zeggen we meestal dat energie behouden blijft. Dat betekent dat we geen energie kunnen creëren of vernietigen, maar alleen omzetten van de ene vorm naar de andere. Dat is van potentiële naar kinetische energie en van kinetische naar potentiële energie.
Waardoor verbinden atomen zich met andere atomen?
Atomen gebruiken hun valentie-elektronen om zich met andere atomen te verbinden. En om een binding tot stand te brengen, moeten atomen ten minste een van de volgende dingen doen:
- elektronen winnen van andere atomen
- elektronen verliezen aan andere atomen
- elektronen delen met andere atomen
En onthoud dat valentie-elektronen de hoogste energie-baan in een atoom bezetten. En je kunt deze elektronen visualiseren als je de elektronenconfiguratie van een atoom schrijft. Als je dat doet met de hoofdgroep elementen uit de eerste en tweede periode, zul je zien dat waterstof één valentie-elektron heeft, stikstof heeft er 5, zuurstof heeft er 6 en neon heeft er 8.
Als we deze valentie-elektronen tekenen door puntjes te zetten op de bovenkant, de rechterkant, de onderkant en de linkerkant van hun chemische symbolen, krijgen we deze eenvoudige diagrammen die Lewis puntdiagrammen worden genoemd, ter ere van Lewis, die ze als eerste gebruikte om het idee van binding uit te leggen. Laten we nu de binding verder bespreken met de volgende Lewis structuren:
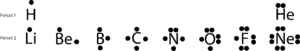
Als je naar de elementen op de tweede periode kijkt, zie je dat alleen Neon (Ne) twee elektronen op elk van zijn vier zijden heeft. Als je alle elektronen op alle vier de zijden bij elkaar optelt, ontdek je dat er acht elektronen omheen zitten.
Het getal acht is verbonden met het laatste cijfer van het groepsnummer waartoe Ne behoort, groep 18. Deze speciale groep elementen, de edelgassen genoemd, zijn onder normale omstandigheden meestal stabiel en niet reactief. Met uitzondering van helium hebben ze allemaal acht valentie-elektronen in de groep.
Omwille van hun chemische gedrag was Lewis in staat af te leiden dat de andere elementen, om een stabiele configuratie als de edelgassen te bereiken, met andere atomen moeten reageren om die te bereiken. Vanuit deze conclusie, stelde Lewis de octet regel voor. De regel van acht.
Maar er zijn uitzonderingen, zoals u kunt zien heeft waterstof slechts twee elektronen nodig om een stabiele configuratie te bereiken zoals He. Ondanks deze en andere tekortkomingen kunnen de puntstructuren van Lewis op een eenvoudige manier verklaren hoe atomen zich binden, zonder dat we complexe atoombanen hoeven te tekenen.
Waardoor verbinden atomen zich met andere atomen?
Energie! Energie is meestal de drijvende kracht achter binding. Om een binding tot stand te brengen, moeten atomen een delicaat evenwicht vinden tussen de aantrekkelijke en afstotende krachten van hun kernen en elektronen. Klik hier om te leren hoe twee waterstofatomen elektronen delen om het waterstofmolecuul te maken.