Trova le fonti: “Pi bond” – notizie – giornali – libri – scholar – JSTOR (Febbraio 2013) (Impara come e quando rimuovere questo messaggio template)
In chimica, i legami pi (π bond) sono legami chimici covalenti in cui due lobi di un orbitale su un atomo si sovrappongono a due lobi di un orbitale su un altro atomo e questa sovrapposizione avviene lateralmente. Ognuno di questi orbitali atomici ha densità di elettroni zero in un piano nodale condiviso, che passa attraverso i due nuclei legati. Lo stesso piano è anche un piano nodale per l’orbitale molecolare del legame pi. I legami pi possono formarsi in legami doppi e tripli ma non in legami singoli nella maggior parte dei casi.
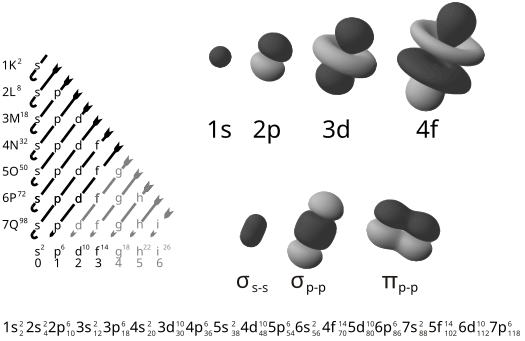

La lettera greca π nel loro nome si riferisce agli orbitali p, poiché la simmetria orbitale del legame pi è la stessa di quella dell’orbitale p quando si vede lungo l’asse del legame. Una forma comune di questo tipo di legame coinvolge gli orbitali p stessi, sebbene anche gli orbitali d si impegnino nel legame pi. Quest’ultima modalità fa parte della base del legame multiplo metallo-metallo.

I legami pi sono solitamente più deboli dei legami sigma. Il doppio legame C-C, composto da un legame sigma e uno pi, ha un’energia di legame inferiore al doppio di quella di un legame C-C singolo, indicando che la stabilità aggiunta dal legame pi è inferiore a quella di un legame sigma. Dal punto di vista della meccanica quantistica, la debolezza di questo legame è spiegata da una sovrapposizione significativamente minore tra gli orbitali p componenti a causa del loro orientamento parallelo. Questo è in contrasto con i legami sigma che formano orbitali di legame direttamente tra i nuclei degli atomi leganti, con conseguente maggiore sovrapposizione e un forte legame sigma.
I legami Pi risultano dalla sovrapposizione di orbitali atomici che sono in contatto attraverso due aree di sovrapposizione. I legami pi sono legami più diffusi dei legami sigma. Gli elettroni nei legami pi sono a volte indicati come elettroni pi. I frammenti molecolari uniti da un legame pi non possono ruotare intorno a quel legame senza rompere il legame pi, perché la rotazione implica la distruzione dell’orientamento parallelo degli orbitali p costituenti.