Perché gli atomi si legano tra loro?
Gli atomi si legano tra loro per abbassare la loro energia e diventare stabili. E quando gli atomi si legano con altri atomi, spesso creano molecole con proprietà chimiche e fisiche uniche. Usiamo il modello qui sotto per spiegare come gli atomi si legano per diventare stabili.
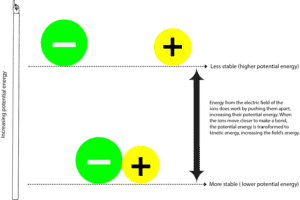
Quando l’atomo carico negativamente (anione) e quello carico positivamente (catione) formano un legame, sono di solito più stabili con un’energia potenziale più bassa. L’energia potenziale è l’energia dovuta alle posizioni relative di questi ioni nel campo elettrico che li circonda. Il campo elettrico è un’area in cui si esercita una forza. Per certi versi, un campo elettrico è simile a un campo magnetico. E si possono vedere queste linee di forza che circondano un magnetico quando si sparge della limatura di ferro intorno ad esso.
Per separare lo ione negativo dallo ione positivo, il campo elettrico che circonda gli ioni deve lavorare tirando questi ioni a parte. Mentre il campo elettrico fa questo, trasferisce anche energia a queste particelle, aumentando la loro energia potenziale. Si può mettere in relazione questo processo con il tirare due magneti che sono attratti l’uno dall’altro. In questo caso, voi siete il campo di forza che fornisce l’energia per separarli, e mentre li separate, i magneti aumentano la loro energia potenziale. E poiché devono fare più lavoro per stare lontani l’uno dall’altro, diventano instabili. Non appena si lascia andare, i due magneti sono rapidamente attratti l’uno dall’altro, abbassando la loro energia potenziale. Ora,
dove è finito il resto dell’energia potenziale?
Quell’energia è stata ritrasferita a te e all’ambiente sotto forma di energia cinetica. L’energia cinetica è l’energia che un oggetto ha quando si muove, e spesso sentiamo questa energia come calore. Quindi, ogni volta che senti calore, significa che l’energia si sta spostando da un luogo più caldo a un luogo più freddo. O detto in un altro modo, da una fonte più concentrata a una meno concentrata. Tenete a mente che l’energia non può mai essere trasferita al contrario – da un luogo più freddo a uno più caldo.
Quindi, quando l’energia viene trasferita da e verso il campo o da e verso l’universo, di solito diciamo che l’energia si conserva. Significa che non possiamo creare o distruggere energia, possiamo solo convertirla da una forma all’altra. Cioè dall’energia potenziale all’energia cinetica e dall’energia cinetica all’energia potenziale.
Cosa usano gli atomi per legarsi ad altri atomi?
Gli atomi usano i loro elettroni di valenza per legarsi ad altri atomi. E perché gli atomi si leghino, devono fare almeno una delle seguenti cose:
- acquistare elettroni da altri atomi
- perdere elettroni ad altri atomi
- condividere elettroni con altri atomi
E ricorda che gli elettroni di valenza occupano l’orbitale di più alta energia in un atomo. E puoi visualizzare questi elettroni quando scrivi la configurazione elettronica di un atomo. Se lo fai con gli elementi del gruppo principale del primo e del secondo periodo, noterai che l’idrogeno ha un solo elettrone di valenza, l’azoto ne ha 5, l’ossigeno ne ha 6 e il neon ne ha 8.
Se disegniamo questi elettroni di valenza mettendo dei punti in alto, a destra, in basso e a sinistra dei loro simboli chimici, otterremo questi semplici diagrammi chiamati diagrammi a punti di Lewis, chiamati così in onore di Lewis, che fu il primo ad usarli per spiegare l’idea di legame. Ora, discutiamo ulteriormente del legame con le seguenti strutture di Lewis:
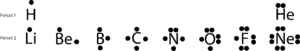
Se guardi gli elementi del secondo periodo, noterai che solo il Neon (Ne) ha due elettroni su ciascuno dei suoi quattro lati. Se sommi tutti gli elettroni su tutti e quattro i lati, scoprirai che ci sono otto elettroni che lo circondano.
Il numero otto è legato all’ultima cifra del numero del gruppo cui appartiene il Ne, il gruppo 18. Questo gruppo speciale di elementi, chiamato gas nobili, tende ad essere stabile e non reattivo in condizioni normali. Con l’eccezione dell’elio, hanno tutti otto elettroni di valenza nel gruppo.
A causa del loro comportamento chimico, Lewis fu in grado di dedurre che, affinché gli altri elementi raggiungano una configurazione stabile come i gas nobili, devono reagire con altri atomi per raggiungerla. Da questa conclusione, Lewis propose la regola dell’ottetto. La regola dell’otto.
Ma ci sono eccezioni, come si può dire, l’idrogeno ha bisogno solo di due elettroni per raggiungere una configurazione stabile simile a He. Nonostante questo e altri difetti, le strutture a punti di Lewis possono spiegare come gli atomi si legano in modo semplice senza che noi disegniamo complessi orbitali atomici.
Cosa fa sì che gli atomi si leghino con altri atomi?
Energia! L’energia è di solito la forza trainante del legame. Affinché gli atomi si leghino, devono trovare un delicato equilibrio tra le forze attrattive e repulsive dei loro nuclei ed elettroni. Per sapere come due atomi di idrogeno condividono gli elettroni per creare la molecola di idrogeno, clicca qui.