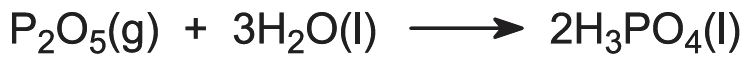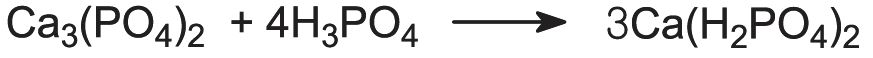Usi dell’acido fosforico
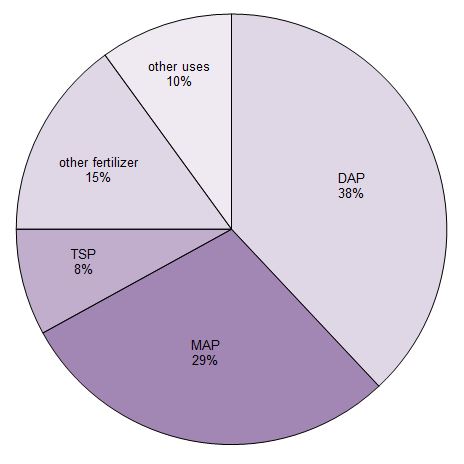
Circa il 90% dell’acido fosforico prodotto è usato per fare fertilizzanti. È principalmente convertito in tre sali di fosfato che sono usati come fertilizzanti. Sono il superfosfato triplo (TSP), l’idrogenofosfato di diamonio (DAP) e il diidrogenofosfato monoammonico (MAP).
Figura 1 Usi dell’acido fosforico.
Dati da Potash Corporation, 2014
I fosfati sono anche usati in una varietà di altri modi, tra cui nelle bevande analcoliche e come supplemento nei mangimi dati a bovini, suini e pollame.
Anche se il loro uso come costruttori nei detergenti è stato gradualmente eliminato in molti paesi, è ancora un uso importante per l’acido in alcuni paesi.
Produzione annuale di acido fosforico
| Mondo | 43 milioni di tonnellate1,2,3 |
| Cina | 17 milioni di tonnellate4 |
| Sud-est e nord-Asia orientale (compresi Indonesia e Giappone) |
10 milioni di tonnellate4 |
| USA | 8.4 milioni di tonnellate5 |
1 Potash Corporation, 2014
2 JDCPhosphate, 2014
3 Stima per il 2016
4 Estrapolata dai dati, IHS,Markit, 2015
5 2015 Business of Chemistry, American Chemistry Council, 2016
Fabbricazione dell’acido fosforico
L’acido fosforico si ottiene con due processi:
a) il processo ‘a umido’
b) processo termico
Il metodo termico normalmente produce un prodotto più concentrato e più puro, ma è ad alta intensità energetica (a causa della fabbricazione del fosforo stesso. L’acido prodotto per via “umida” è meno puro ma è usato nella fabbricazione di fertilizzanti.
(a) Processo umido
L’acido fosforico è prodotto dalla fluoroapatite, conosciuta come roccia di fosfato, 3Ca3(PO4)2.CaF2, per aggiunta di acido solforico concentrato (93%) in una serie di reattori ben agitati. Questo produce acido fosforico e solfato di calcio (gesso) più altre impurità insolubili. Viene aggiunta acqua e il gesso viene rimosso per filtrazione insieme ad altri materiali insolubili (ad esempio, silice). Il fluoruro, come H2SiF6, viene rimosso in una fase successiva per evaporazione.
Anche se la reazione avviene in fasi che coinvolgono il diidrogenofosfato di calcio, la reazione complessiva può essere rappresentata come:
Tuttavia, ci sono reazioni collaterali; per esempio con fluoruro di calcio e carbonato di calcio presenti nella roccia:


L’acido fluorosilicilico è un importante sottoprodotto di questo e della fabbricazione del fluoruro di idrogeno. Può essere neutralizzato con idrossido di sodio per formare esafluorosilicato di sodio. L’acido è anche usato per fare fluoruro di alluminio, usato a sua volta nella fabbricazione dell’alluminio.
La struttura cristallina del solfato di calcio formato dipende dalle condizioni della reazione. A 340-350 K, il prodotto principale è il diidrato, CaSO4.2H2O. A 360-380 K, si produce l’emiidrato, CaSO4.1/2H2O.
Il solfato di calcio viene filtrato e l’acido viene poi concentrato a circa il 56% di P2O5 usando la distillazione sotto vuoto.
Il prodotto dell’acido “processo umido” è impuro ma può essere usato, senza ulteriore purificazione, per la produzione di fertilizzanti (vedi sotto). In alternativa, può essere ulteriormente evaporato fino al 70% circa di P2O5, una soluzione chiamata acido superfosforico che viene usata direttamente come fertilizzante liquido.
Per fare i fosfati industriali, l’acido viene purificato tramite estrazione con solvente usando, per esempio, metil isobutil chetone (MIBK) in cui l’acido è leggermente solubile e concentrato per dare il 60% di P2O5. Questo acido può essere ulteriormente purificato usando solventi per estrarlo dai metalli pesanti e defluorato (per evaporazione) per produrre un prodotto di qualità alimentare.
(b) Processo termico
Le materie prime per questo processo sono il fosforo e l’aria:
Inzialmente, il fosforo viene spruzzato nel forno e viene bruciato in aria a circa 1800-3000 K.
La maggior parte dei processi utilizza aria non essiccata e molti prevedono l’aggiunta di vapore al bruciatore di fosforo per produrre e mantenere una pellicola di acidi polifosforici condensati che proteggono la torre del bruciatore in acciaio inossidabile (raffreddata esternamente ad acqua). I prodotti della torre del bruciatore passano direttamente in una torre di idratazione dove l’ossido di fosforo gassoso è assorbito nell’acido fosforico riciclato:
In alternativa, il fosforo può essere bruciato in aria secca. Il pentossido di fosforo viene condensato come polvere bianca e idratato separatamente in acido fosforico.
Questo metodo permette di recuperare e riutilizzare il calore.
La combustione e l’idratazione diretta, come descritto precedentemente, creano condizioni altamente corrosive. L’attrezzatura è costruita in acciaio inossidabile o è rivestita di mattoni di carbonio. Per ridurre la corrosione, le pareti del bruciatore e le torri di idratazione sono raffreddate, ma i prodotti del reattore emergono a una temperatura troppo bassa per un utile recupero di calore.
L’acido prodotto ha una concentrazione di circa 85%.
L’acido tetrafosforico, uno di una famiglia di acidi polifosforici che possono essere prodotti selettivamente, è fatto sia bollendo l’acqua ad alte temperature in un recipiente di carbonio, o aggiungendo pentossido di fosforo solido all’acido fosforico quasi bollente. Il primo metodo dà solitamente il prodotto più puro, a causa dell’alto contenuto di arsenico del pentossido di fosforo.
Fosfati
I sali dell’acido fosforico, i fosfati, sono i composti che sono ampiamente usati in agricoltura, nell’industria e in casa.
(a) Fosfati di ammonio
Il diidrogenofosfato monoammonico e l’idrogenofosfato di ammonio sono molto usati come fertilizzanti e sono fatti mescolando le giuste proporzioni di acido fosforico con ammoniaca anidra in un tamburo rotante.
La scelta di quale fosfato di ammonio usare dipende dalla proporzione di azoto e fosforo necessari per il raccolto.
(b) Fosfati di calcio
I fosfati di calcio sono molto usati come fertilizzanti. Il diidrogenofosfato di calcio, Ca(H2PO4)2, è prodotto dalla reazione della roccia fosfatica con l’acido solforico:
Questo è conosciuto come superfosfato. Contiene circa il 20% di P2O5.
Se la roccia di fosfato viene trattata con acido fosforico, piuttosto che con acido solforico, si produce una forma più concentrata di diidrogenofosfato di calcio con un livello complessivo di P2O5 più alto (50%):
Questo è conosciuto come superfosfato triplo. Il livello più alto di fosfato si ottiene perché il prodotto non è più diluito con il solfato di calcio.
(c) Fosfati di sodio
I fosfati di sodio sono prodotti per reazione di acido fosforico e una soluzione concentrata di idrossido di sodio nelle proporzioni appropriate (stechiometriche). Il prodotto cristallizza.
- Il diidrogenofosfato monosodico (MSP, NaH2PO4) è usato nella pulizia dei metalli e nelle formulazioni di preparazione delle superfici, come fonte di fosfato nella produzione farmaceutica, e come agente di controllo del pH nei dentifrici, nel rivestimento di smalto vitreo (articoli sanitari) e nella produzione di fosfati di amido. Uno dei maggiori utilizzi è come trattamento di plumbosolvency nell’acqua potabile. Sia l’acido fosforico che l’MSP possono essere usati per produrre un sottile rivestimento insolubile di fosfato di piombo sui tubi di piombo per prevenire la dissoluzione del piombo da parte degli acidi nell’acqua.
- L’idrogenofosfato disodico (Na2HPO4) è usato come agente ammorbidente nel formaggio lavorato, negli smalti e negli smalti ceramici, nella concia del cuoio, nella produzione di tinture e come inibitore di corrosione nel trattamento dell’acqua.
- Il fosfato trisodico (Na3PO4) è usato nei detergenti pesanti, per esempio per sgrassare l’acciaio. È un alcali e un sequestrante per gli ioni di calcio, mantenendoli in soluzione e prevenendo la formazione di una schiuma.
- Il pirofosfato disodico (Na2H2P2O7) è usato come agente lievitante nel pane/pasticceria (aiuta la liberazione di anidride carbonica dal bicarbonato di sodio), come soppressore dell’ossido di ferro (effetto scurente o imbrunente) nella produzione di vari alimenti e come disperdente nel fango di perforazione dei pozzi petroliferi.