
Parole chiave:
amorfo,cristallo
Vetro a livello molecolare
Parliamo di vetro di tanto in tanto quando parliamo di polimeri, specialmente quando parliamo di materiali compositi. Le fibre di vetro sono spesso usate per rinforzare i polimeri. Ma cos’è questa roba chiamata vetro? Lo usiamo spesso con i polimeri, ovviamente, ma il vetro stesso è un polimero?
Prima di affrontare questa domanda, diamo un’occhiata a cos’è il vetro. Il vetro di alta qualità ha la formula chimica SiO2. Ma questo è fuorviante. Questa formula evoca l’idea di piccole molecole di biossido di silicio, analogamente alle molecole di anidride carbonica. Ma le piccole molecole di biossido di silicio non esistono.

 In natura, invece, il SiO2 si trova spesso come un solido cristallino, con una struttura come quella che vedete sulla destra. Ogni atomo di silicio è legato a quattro atomi di ossigeno, tetraedricamente, naturalmente; e ogni atomo di ossigeno è legato a due atomi di silicio. Quando SiO2 è in questa forma cristallina lo chiamiamo silice. Avete già visto la silice. Quando si trovano dei grossi cristalli, lo chiamiamo quarzo. Quando ne abbiamo tanti piccoli cristalli, la chiamiamo sabbia.
In natura, invece, il SiO2 si trova spesso come un solido cristallino, con una struttura come quella che vedete sulla destra. Ogni atomo di silicio è legato a quattro atomi di ossigeno, tetraedricamente, naturalmente; e ogni atomo di ossigeno è legato a due atomi di silicio. Quando SiO2 è in questa forma cristallina lo chiamiamo silice. Avete già visto la silice. Quando si trovano dei grossi cristalli, lo chiamiamo quarzo. Quando ne abbiamo tanti piccoli cristalli, la chiamiamo sabbia.
Ma questa silice non è vetro. Dobbiamo fare qualcosa prima per trasformarla in vetro. Dobbiamo riscaldarla fino a farla fondere, e poi raffreddarla molto velocemente. Quando si scioglie, gli atomi di silicio e di ossigeno escono dalla loro struttura cristallina. Se lo raffreddassimo lentamente, gli atomi tornerebbero lentamente nella loro disposizione cristallina mentre rallentano. (Ricordate, il calore è in realtà solo il movimento casuale di atomi e molecole. Gli atomi caldi si muovono molto, quelli freddi molto poco.)
Ma se lo raffreddiamo abbastanza in fretta, gli atomi della silice saranno fermati sulle loro tracce, per così dire. Non avranno il tempo di allinearsi, e saranno bloccati in una disposizione qualsiasi. Avranno un aspetto simile a questo:v
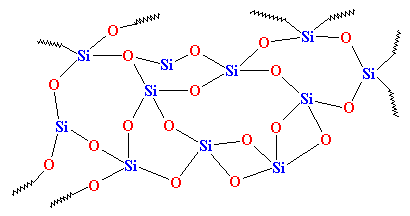
Come potete vedere, non c’è ordine nella disposizione degli atomi. Chiamiamo materiali come questo amorfi. Questo è il vetro che si usa per le lenti dei telescopi e cose del genere. Ha ottime proprietà ottiche, ma è fragile. Per gli usi quotidiani, abbiamo bisogno di qualcosa di più duro. La maggior parte del vetro è fatto di sabbia, e quando fondiamo la sabbia, di solito aggiungiamo del carbonato di sodio. Questo ci dà un vetro più duro con una struttura simile a questa:
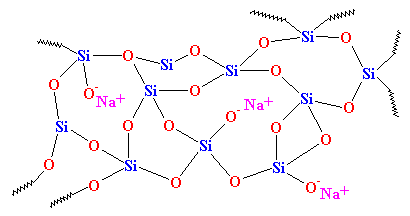
Questo è il vetro che si vede tutti i giorni, nei vasi e nelle finestre, ed è il vetro usato nei compositi. Infatti, una volta si chiamava “vetro soda” per distinguerlo dal quarzo.
Quindi è un polimero o no? Di solito non è considerato tale. Perché? Alcuni potrebbero dire che è inorganico, e i polimeri sono di solito organici. Ma ci sono molti polimeri inorganici là fuori. Per esempio, che dire dei polisilossani? Questi materiali lineari e sì, inorganici hanno una struttura molto simile al vetro, e sono considerati polimeri. Date un’occhiata a un polisilossano:
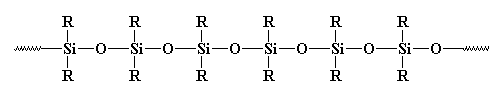
E allora che dire della reticolazione?
In un certo senso, il vetro potrebbe essere considerato un polisilossano altamente reticolato. Ma di solito non ci pensiamo in questo modo. Perché no? Probabilmente perché anche in un sistema altamente reticolato, si potrebbe ancora tracciare una catena polimerica e vedere dove sono i reticolati. Ma con il vetro sarebbe difficile farlo.
Ecco un confronto che illustra questo punto: fibre di carbonio e nanotubi di carbonio. Aggiungete un po’ di diamante per rendere questa famiglia completa. “Quale famiglia?” vi chiederete. Semplicemente quella del carbonio legato ad altri carboni in una matrice bidimensionale o tridimensionale, e NON legato ad altro. Carbonio puro!
Perché il carbonio completamente reticolato non è un polimero?
Ora ricordate che il carbonio vuole davvero essere legato ad altri quattro atomi. Di solito si tratta di altri quattro atomi distinti, ma contano anche i legami multipli allo stesso atomo. È qui che entra in gioco la maggior parte dei monomeri vinilici: hanno un doppio legame carbonio-carbonio, il che significa che ogni carbonio nel vinile può essere legato solo ad altri due atomi oltre al carbonio all’altra estremità del doppio legame: quattro legami in totale.
Ora la parte interessante. Nel grafene, nelle fibre di carbonio e nei nanotubi di carbonio, i carboni sono SOLO legati ad altri atomi di carbonio. In questi composti, tuttavia, ogni carbonio ha una combinazione di doppi e singoli legami, il che crea un insieme di orbite molecolari altamente delocalizzato. Ciò significa che questi materiali conducono elettroni e sono elettricamente conduttivi. Esperimento interessante: mettete un mucchio di fibre di carbonio in un microonde e dategli una scossa: fiamme e fumo quando gli elettroni che si muovono nel materiale reagiscono con l’ossigeno e vanno in fumo!
Il diamante è ancora più interessante, essendo il materiale più duro conosciuto. Perché è così duro, eppure trasparente e capace di rifrangere la luce in modo così bello? È solo carbonio puro, dopo tutto, ma con un trucco: ora ogni carbonio ha quattro legami singoli con altri quattro atomi di carbonio. Questa serie perfettamente simmetrica di carboni ha una serie perfetta di legami che vanno in quattro direzioni diverse. “Non c’è niente di meglio”, si potrebbe dire.
Quindi queste reti di soli carboni sono considerate polimeri? No, e per la stessa ragione per cui il vetro non lo è. Tutto si riduce alle convenzioni e alla storia. Da quando abbiamo capito com’è fatto un polimero organico, il vetro e il diamante non sono più adatti. Un pregiudizio, se volete, dato che soddisfano il requisito di un polimero completamente reticolato. Oh, beh, altre battaglie da combattere…
 |
Ritorna alla directory di livello tre |
 |
Ritorno alla Directory Macrogalleria |