Le molecole nei tessuti non sono fisse in posizione ma si muovono nel tempo. Alcuni di questi movimenti sono legati a processi attivi come la circolazione del sangue, mentre altri sono semplicemente movimenti casuali senza uno scopo netto. Quest’ultimo fenomeno è legato al calore (energia) nel tessuto e viene definito movimento browniano. Come notato, non c’è una direzione netta del flusso – le molecole semplicemente si agitano e rimbalzano nella soluzione, muovendosi lungo un percorso casuale, cambiando direzione quando si scontrano con altre molecole. Il movimento delle molecole nel tempo è chiamato diffusione molecolare.
Il movimento di queste molecole d’acqua può essere limitato dalla presenza di barriere, principalmente le membrane cellulari. Potete vedere un’illustrazione di questo processo qui sotto. Il grado di restrizione della diffusione può essere quantificato da un coefficiente di diffusione, che riflette la distanza media che una particella percorre in un secondo; il coefficiente di diffusione effettivo di solito non è importante, ma è utile per la terminologia.
| Acqua libera | Acqua intracellulare |
| Il tuo browser non supporta il canvas HTML. | Il tuo browser non supporta il canvas HTML. |
|
|
|
Illustrazione del moto browniano; a sinistra, diffusione libera dell’acqua e a destra, moto limitato da una membrana cellulare. Esegui la simulazione più volte per vedere come i percorsi sono limitati dalla cellula. La linea rossa segna il percorso della molecola, mentre la linea grigia mostra lo spostamento netto alla fine della corsa.
Come potete immaginare, i cambiamenti nella densità cellulare del tessuto e la quantità di acqua intracellulare rispetto a quella extracellulare avranno un impatto sul grado di restrizione della diffusione all’interno di quel volume di tessuto. Condizioni come infarti ischemici nel cervello, ascessi piogenici e piccoli tumori a cellule blu tendono a produrre una diffusione altamente ristretta; cisti ed edema producono bassi gradi di restrizione della diffusione.
Diffusion-Weighted Imaging
Gradienti di diffusione. Come abbiamo sottolineato, la diffusione può variare in base a una patologia sottostante; la capacità di misurare e confrontare i coefficienti di diffusione all’interno di un organo è importante per un numero crescente di applicazioni, come la valutazione di ictus acuto. Una sequenza di impulsi MR può essere progettata per essere sensibile alla diffusione molecolare, utilizzando concetti simili a quelli responsabili del dephasing legato al flusso e della MRA a contrasto di fase. In particolare, le particelle che si muovono tra l’applicazione di due impulsi di gradiente spaziale sperimenteranno diverse intensità di gradiente (poiché sono in posizioni diverse).
Ricordo che l’applicazione di un impulso di gradiente induce uno spostamento di fase nella precessione del protone; per rivedere questo concetto, è possibile leggere la sezione sulla codifica di fase per la localizzazione spaziale. Se applichiamo un gradiente e poi lo invertiamo esattamente, le particelle che si trovano nella stessa posizione non subiranno alcuno spostamento di fase netto, mentre le particelle che si sono spostate finiranno con uno spostamento di fase.
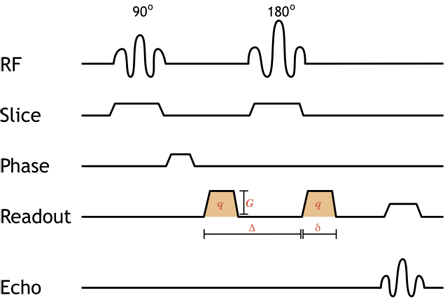
Semplificato diagramma di impulso di una sequenza di immagini pesate per diffusione in spin-echo. I gradienti arancioni ombreggiati sono i gradienti di diffusione (si noti che sono entrambi positivi poiché l’impulso di 180 gradi tra loro inverte la direzione della precessione, quindi il secondo è davvero negativo). L’aggiunta di gradienti di diffusione uguali e accoppiati alla sequenza standard di spin-echo fa sì che i protoni in movimento si deformino. Il grado di ponderazione della diffusione dipende dalla forza del gradiente (ampiezza G e durata δ) così come la spaziatura temporale tra loro (Δ) – questo è indicato come il valore b, discusso di seguito.
Il tuo browser non supporta il canvas HTML.
Illustrazione dei gradienti utilizzati per l’imaging pesato in diffusione. Nella metà superiore dell’immagine, due protoni grigi stazionari sono rappresentati; nella metà inferiore ci sono due protoni mobili blu. Il gradiente di diffusione (che varia lungo l’asse x) è mostrato in basso in rosso quando è acceso. Il pannello di destra visualizza la fase netta del ‘voxel’ contenente entrambi i protoni; la lunghezza della linea diminuisce come i protoni dephase.For i protoni stazionari, si noti che sono sincronizzati all’inizio della sequenza di impulsi, dephase con il gradiente, e poi rephase come il gradienteis invertito. Tuttavia, i protoni mobili non possono rifasare poiché si sono spostati – non sperimenteranno la stessa forza del gradiente come hanno fatto inizialmente.Questi protoni accumulano spostamenti di fase disuguali, e il segnale netto è diminuito (dephasing).
b value. Per un’immagine ponderata per la diffusione, possiamo alterare la quantità di ponderazione DWI che vogliamo, cioè qual è la nostra “soglia” di restrizione della diffusione. regolando la spaziatura temporale e la forza dei gradienti di diffusione, possiamo rendere l’immagine più o meno sensibile al movimento molecolare. Rendendo il gradiente o aumentando il tempo tra i gradienti di dephasing e rephasing causerà molto più dephasing dalla stessa quantità di movimento browniano. Il grado di ponderazione DWI è indicato come il valore b (quantitativamente, b ∝ q2 * Δ, dove q è la forza del gradiente e Δ è il tempo tra i due gradienti). Le immagini a basso valore b sono solo leggermente influenzate dalle proprietà di diffusione dei tessuti. Un valore b più alto darà un’immagine complessivamente più scura, poiché la maggior parte dei tessuti perderà il segnale dal movimento molecolare – ma le lesioni limitate saranno più evidenti; in genere acquisiamo più valori b per motivi discussi di seguito per calcolare un’immagine ADC. Vedi sotto per una simulazione che illustra questo punto.
Sequenza d’impulso DWI. Possiamo ora discutere i dettagli pratici – come si acquisisce un’immagine pesata in diffusione? Le tipiche sequenze DWI sono ecosequenze di spin, con impulsi di 90 e 180 gradi. (Si stanno sviluppando nuovi modi di eseguire la DWI, non tutti usano sequenze di spin echo). I gradienti di diffusione sono accesi prima e dopo l’impulso di 180 gradi (sono quindi entrambi gradienti positivi perché l’impulso di 180 gradi serve a invertire l’effetto del secondo impulso). Le sequenze DWI devono essere estremamente veloci per eliminare qualsiasi movimento all’interno della parte del corpo – poiché l’intero scopo della sequenza DWI è di misurare i movimenti infinitesimali delle molecole d’acqua, le nostre immagini saranno completamente distrutte dai movimenti macroscopici. Per molto tempo, la sequenza più veloce disponibile è stata l’imaging ecoplanare (EPI), e praticamente tutte le sequenze DWI attualmente utilizzate utilizzano EPI.
Idealmente, vorremmo che le nostre immagini DWI fossero interamente ‘ponderate DWI’ – in altre parole, vorremmo vedere solo i risultati della diffusione, non altre proprietà del tessuto. Il TR è lungo per ridurre gli effetti T1 e migliorare il segnale. Il TE è mantenuto il più corto possibile, ma l’inserimento del gradiente di diffusione dopo l’impulso 180 richiede un TE più lungo; pertanto, le immagini DWI sono anche pesate in T2. Questo è un punto molto importante da notare – le lesioni possono essere luminose in DWI solo per gli effetti del T2 (questo è noto come T2 shine-through), e le lesioni con diffusione ristretta e lungo rilassamento T2 appariranno molto luminose!
Grasso. Il grasso crea problemi nella DWI per diverse ragioni. In primo luogo, è luminoso sulle immagini DWI perché le molecole di grasso non si muovono molto (sono relativamente limitate); il segnale del grasso potrebbe oscurare le lesioni. In secondo luogo, l’artefatto da spostamento chimico (del primo tipo) è molto esagerato dall’imaging eco-planare (EPI), spesso circa 10 pixel di spostamento! (Questo perché gli spostamenti di fase si accumulano attraverso il singolo colpo della sequenza EPI; per una discussione tecnica, vedere i riferimenti). Così, il grasso dai tessuti sottocutanei potrebbe oscurare le lesioni nel cervello o nel fegato. Per entrambe queste ragioni, la soppressione omogenea del grasso è necessaria per le immagini DWI.
Coefficiente di diffusione apparente
Come discusso sopra, le immagini DWI sono intrinsecamente pesate in T2. Pertanto, le lesioni con un lungo rilassamento T2 appariranno luminose, anche se non limitano la diffusione. Questo effetto sarà particolarmente evidente sulle immagini a basso valore b, dove la ponderazione della diffusione è minore (cioè le lesioni con diffusione veloce hanno perso molto segnale e quindi saranno ancora luminose). A causa del suo T2 estremamente lungo, l’acqua libera (es. CSF, cisti) sarà luminosa anche su immagini di valore b relativamente alto. Vorremmo eliminare gli effetti del T2 per ottenere un’idea più accurata della restrizione della diffusione ed eliminare i punti luminosi spuri. Per fare questo, possiamo effettivamente calcolare il coefficiente di diffusione usando diverse serie DWI con diversi valori b.
Coefficiente di diffusione apparente. I coefficienti di diffusione che misuriamo con la RM rappresentano le medie dell’intero voxel e di ogni direzione di diffusione (vedi la discussione sull’anisotropia e la DTI più avanti). Pertanto, usiamo la parola apparente per descrivere i valori che calcoliamo. Il segnale di un particolare tessuto diminuisce esponenzialmente con l’aumentare del valore b. Dato un coefficiente di diffusione apparente D, l’intensità del segnale I è
I = I0 * e-b * D, dove I0 dipende dalle caratteristiche T2
Se acquisiamo almeno 2 sequenze DWI con diversi valori b, possiamo inserirle nell’equazione per risolvere D. In genere, vengono usati almeno 3 diversi valori b per migliorare il rumore (es.Ad esempio, 40, 400 e 800); possiamo prendere il log dell’intensità per linearizzare il grafico e poi usare la regressione lineare per ottenere il miglior valore di D. Tracciando D per ogni pixel, otteniamo l’immagine ADC (a volte chiamata mappa ADC).
|
Valore b del DWI: |
ADC |
|
| Il tuo browser non supporta l’HTML Canvas. | Il tuo browser non supporta l’HTML Canvas. |
Simulazione di come diversi valori b influenzano l’aspetto delle immagini DWI e come calcolare ADC. A sinistra, immagini DWI simulate che mostrano CSF luminoso sulle immagini a basso valore b e una maggiore visibilità del colpo frontale sinistro sulle immagini ad alto valore b. Centro, grafico del log dell’intensità del segnale di diversi tessuti (blu, CSF; grigio, cervello; marrone, ictus) a vari valori b. La pendenza della linea che collega il punto è l’ADC. A destra, immagine ADC simulata; le aree di restrizione della diffusione, che hanno la pendenza più piatta sul grafico centrale, hanno il segnale più scuro sull’immagine ADC.
Le aree di restrizione della diffusione perderanno meno segnale sulle immagini ad alto valore b (perché i loro protoni non sono in movimento). La pendenza della linea sul grafico DWI (vedi sopra) sarà piatta, e quindi il valore ADC sarà piccolo (quindi, pixel scuri). D’altra parte, le aree di diffusione veloce perderanno la maggior parte del segnale all’aumentare dei valori b, dando una grande pendenza – e pixel luminosi sull’immagine ADC. È importante notare che il T2 shine-through – cioè la luminosità sulle immagini DWI relativa al segnale T2 sottostante nel tessuto – influisce solo sulla posizione iniziale dei punti nel grafico DWI; non influisce sulla pendenza, quindi l’immagine ADC è indipendente dal T2 shine-through – riflette solo la diffusione.
Clinicamente, usiamo ancora le immagini DWI perché le anomalie luminose sono molto più facili da vedere di quelle scure (si può notare questo nella simulazione sopra). Le persone hanno sviluppato diverse strategie per trasformare l’immagine ADC in una mappa “luminosa = cattiva”; per esempio, la mappa ADC esponenziale (EADC) prende l’esponenziale dei valori ADC, portando a una scala invertita più simile alla DWI (ma di nuovo, eliminando gli effetti T2 shine-through). Un’altra ragione importante per utilizzare le immagini DWI è che perché l’immagine ADC si basa su diverse immagini DWI, è intrinsecamente più suscettibile di artefatti rispetto alle immagini DWI individuali. Infine, per molte anomalie, esse non solo limitano la diffusione, ma sono luminose in T2; così, possiamo effettivamente approfittare dell’effetto T2 shine-througheffect per rendere le lesioni più cospicue, quindi confermare la vera restrizione della diffusione sulla mappa ADC.
Diffusion Tensor Imaging
Finora, abbiamo avuto una visione semplicistica della diffusione – che le molecole d’acqua possono diffondere in tutte le direzioni allo stesso modo. In realtà, almeno in alcuni tessuti, questo non è affatto vero. Nei tessuti altamente strutturati, in particolare i nervi e i tratti di materia bianca nel cervello, la diffusione avviene preferenzialmente lungo una direzione: nella materia bianca, le guaine mieliniche circondano i neuroni e impediscono la diffusione dell’acqua attraverso la guaina, ma la permettono lungo la direzione degli assoni. La diffusione che dipende dalla direzione è detta anisotropa (cioè non è uguale in ogni direzione). Ciò significa che se misuriamo la diffusione usando i gradienti in una direzione, otterremo una risposta diversa da quella che otterremmo misurandola in un’altra direzione. Ugualmente importante, se misuriamo la diffusione in una direzione, otterremo risposte diverse per parti diverse della stessa materia bianca (sana), a seconda della direzione degli assoni in ogni parte.
Intuitivamente, si potrebbe pensare che la soluzione a questo problema sia misurare la diffusione in diverse direzioni e creare una sorta di media – questo annullerebbe qualsiasi bias direzionale. Il metodo più semplice per misurare la diffusione in diverse direzioni è chiamato tensore di diffusione o DTI.DTI assume che all’interno di ogni voxel c’è un singolo bias direzionale, ad esempio una singola direzione del fascio neuronale. Quindi modella la diffusione all’interno di un assone non come uno scalare (numero singolo) ma come un ellissoide tridimensionale, che è chiamato tensore.

Illustrazione del tensore di diffusione. Un fascio di assoni (giallo) è illustrato in 3 dimensioni. Le molecole d’acqua possono diffondere lungo gli assoni ma non attraverso di essi. Il tensore di diffusione (marrone) rappresenta la diffusione come un ellissoide, orientato lungo gli assoni con lo spessore dell’ellissoide in qualsiasi direzione corrispondente al coefficiente di diffusione in quella particolare direzione. Così, l’ellisse ha una vita sottile poiché l’ADC è bassa attraverso gli assoni, ma l’ellisse è allungata poiché l’ADC è alta lungo l’asse degli assoni.
Dall’illustrazione sopra, si può vedere che specificare il tensore di diffusione richiede due serie separate di parametri: la direzione della diffusione più veloce (cioè la direzione del fascio di assoni) e i coefficienti di diffusione effettivi lungo e attraverso gli assoni. Una direzione nello spazio tridimensionale richiede 3 numeri; e lo spessore dell’ellisse richiede 3 numeri (per ogni asse dell’ellisse stessa). Ciò significa che la DTI richiede la misurazione della diffusione in 6 direzioni diverse. (Queste direzioni devono essere misurate per ogni valore b non nullo.)
Le sequenze DTI sono necessarie per produrre immagini ponderate per la diffusione anche regolari nel cervello – altrimenti i tratti di materia bianca sembreranno limitare la diffusione. Le immagini di diffusione media sono poi prodotte facendo la media di tre delle direzioni, e questo è ciò che viene tipicamente usato per le mappe DWI e ADC. Una delle più comuni è la mappa dell’anisotropia frazionale (FA). Ricordiamo che l’anisotropia rappresenta il grado in cui la diffusione non è la stessa in tutte le direzioni; FA è calcolata confrontando le lunghezze di ogni asse dell’ellissoide del tensore con la loro media. Se c’è una grande differenza (come nell’illustrazione sopra), allora la FA è alta, rappresentando la diffusione anisotropa. I tratti di materia bianca normali hanno un’alta FA, che si perde in molti processi patologici.
Trattografia. Infine, la DTI può produrre buone immagini a bassa risoluzione delle direzioni generali della materia bianca; calcolando la direzione principale dell’ellissoide del tensore, otteniamo la direzione media dei fasci assonali nel voxel. Possiamo colorare i voxel per direzione, ottenendo una mappa di trattografia. Una trattografia molto più sofisticata e ad alta risoluzione può essere ottenuta misurando la diffusione in più direzioni. Questo può prendere in considerazione le aree dei fasci di fibre che si incrociano (che sarebbero solo mediate nella DTI regolare). Ottenendo queste mappe, possiamo creare mappe di connettività cerebrale 3-dimensioal in vivo. Questa è attualmente un’area di ricerca attiva.
Intravoxel Incoherent Motion
La DWI tradizionale presuppone che tutte le molecole d’acqua all’interno di un voxel si comportino allo stesso modo (quindi un singolo ADC per voxel). Naturalmente, questo non è vero: le molecole d’acqua sperimentano ambienti molto diversi anche all’interno di un singolo voxel. Le molecole nel sangue che scorre hanno una velocità di base e quindi si diffondono molto rapidamente; i compartimenti intra ed extracellulari hanno anche diversa diffusività. Mentre il modello semplicistico è sufficiente per la maggior parte degli scopi clinici (per esempio l’ictus), i dati emergenti suggeriscono che alcuni risultati clinicamente rilevanti possono essere trovati in modelli più complessi. Le due principali categorie di modellazione avanzata della diffusione sono la diffusionkurtosis imaging, non discussa qui, e l’intravoxel incoerent motion (IVIM).
Nella nostra precedente discussione sull’ADC, abbiamo assunto che la relazione tra valore b e intensità del segnale sia lineare – in altre parole che ci sia un singolo valore ADC per un voxel. Infatti, in alcuni tessuti la relazione non è lineare. In particolare, la caduta dell’intensità del segnale è molto più ripida a bassi valori di b; questo implica che c’è una piccola sottopopolazione di molecole d’acqua a diffusione molto veloce. Questo fenomeno è più evidente nel fegato, e si ritiene che sia legato al flusso di sangue nei capillari (anche se la nostra comprensione è incompleta). Per misurare l’IVIM, invece di misurare l’ADC usando 3 valori b, dobbiamo usarne di più (per esempio 8) – specialmente a bassi valori b. Attualmente, IVIM è in fase di esplorazione come misura per la fibrosi epatica.
- Hagmann P, et al. “Understanding Diffusion MR Imaging Techniques: Da Scalar Diffusion-weighted Imaging a Diffusion Tensor Imaging e oltre”. Radiographics 26(S1): S205.
- Koh D, et al. “Intravoxel Incoerent Motion in Body Diffusion-Weighted MRI: Realtà e sfide”. Am J Roentgenol 188(6): 1622.
- Dietrich O, et al. “Aspetti tecnici dell’imaging di diffusione MR del corpo”. Eur J Radiol 76: 314.
- “Chemical Shift: Effetti di fase”. MRI-Questions – discussione sull’esagerazione del chemicalshift nelle sequenze EPI
- Se siete interessati al documento originale (altamente tecnico!) su DWI: Stejskal EO e Tanner JE. “Misure di diffusione in spin: Spin Echoes in presenza di un gradiente di campo dipendente dal tempo”. J Chem Phys 42 (288): 288.