Obiettivi di apprendimento
- Determinare la suscettibilità di varie specie batteriche a vari antibiotici e agenti sintetici.
Un vero antibiotico è una sostanza chimica antimicrobica prodotta da microorganismi contro altri microorganismi. L’umanità ha fatto un ottimo uso di questi antimicrobici nella sua lotta contro le malattie infettive. Molti farmaci sono ora completamente sintetici o il farmaco naturale è manipolato per cambiare un po’ la sua struttura, questi ultimi chiamati semisintetici. I batteri rispondono in modi diversi agli antibiotici e ai farmaci chemiosintetici, anche all’interno della stessa specie. Per esempio, lo Staphylococcus aureus è un comune batterio della flora normale che si trova nel corpo. Se si isolasse questo batterio da 5 persone diverse, i 5 isolati sarebbero probabilmente ceppi diversi, cioè leggermente diversi geneticamente. È anche probabile che se i test di sensibilità antibiotica fossero eseguiti su questi isolati, i risultati varierebbero contro i diversi antibiotici utilizzati.
Il test di Kirby-Bauer per la suscettibilità agli antibiotici (chiamato anche test di diffusione del disco) è uno standard che è stato usato per anni. Sviluppato per la prima volta negli anni ’50, è stato perfezionato e da W. Kirby e A. Bauer, poi standardizzato dall’Organizzazione Mondiale della Sanità nel 1961. È stato sostituito nei laboratori clinici da test automatizzati. Tuttavia, il K-B è ancora usato in alcuni laboratori, o usato con certi batteri con cui l’automazione non funziona bene. Questo test è usato per determinare la resistenza o la sensibilità di aerobi o anaerobi facoltativi a sostanze chimiche specifiche, che possono poi essere utilizzate dal medico per il trattamento di pazienti con infezioni batteriche. La presenza o l’assenza di un’area inibitoria intorno al disco identifica la sensibilità batterica al farmaco (Figura \PageIndex{1}).
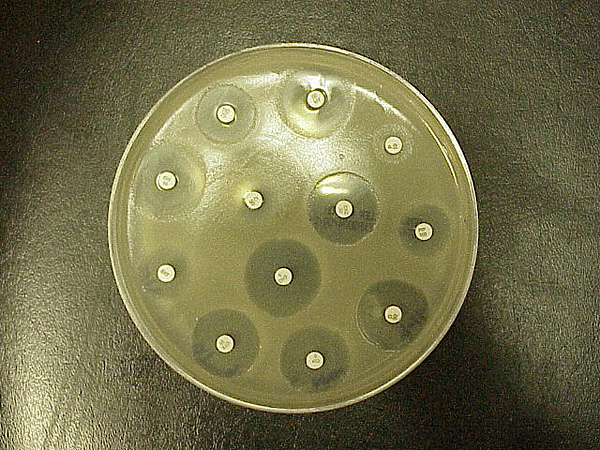
Le basi sono facili: il batterio viene tamponato sull’agar e i dischi di antibiotico vengono posti sopra. L’antibiotico si diffonde dal disco nell’agar in quantità decrescenti quanto più è lontano dal disco. Se l’organismo viene ucciso o inibito dalla concentrazione dell’antibiotico, non ci sarà alcuna crescita nell’area immediatamente circostante il disco: Questa è chiamata zona di inibizione (Figura 9.1). Le dimensioni della zona vengono cercate su una tabella standardizzata per dare un risultato di sensibile, resistente o intermedio. Molte tabelle hanno una colonna corrispondente che dà anche la MIC (concentrazione minima inibitoria) per quel farmaco. La MIC è attualmente il test standard per i test di sensibilità agli antibiotici perché produce informazioni più pertinenti sui dosaggi minimi.
Il terreno di Mueller-Hinton usato per il test di Kirby-Bauer è molto ricco di proteine.
MATERIALI NECESSARI: per tabella
- 2 piastre di agar Mueller-Hinton
- colture vecchie di 24 ore (probabilmente di Staph, E. coli, Bacillus subtilus, Enterococcus fecalis) tamponi sterili
- antibiotici
- etanolo
- forcipe
- Pseudomonas aeruginosa Kirby-Bauer per la dimostrazione
- tabella delle linee guida per l’interpretazione della suscettibilità antibiotica
LA PROCEDURE
Seconda copertura del tampone ►

- Tamponare una piastra Mueller-Hinton con SOLO 2 dei batteri (i tavoli eseguiranno diverse combinazioni dei 4 batteri). Immergere un tampone sterile nel brodo ed esprimere l’umidità in eccesso premendo il tampone contro il lato della provetta.
- Tamponare completamente la superficie dell’agar (non si vuole lasciare alcuna area di agar non tamponata). Nelle immagini qui sotto, si può vedere cosa succede quando la piastra non è tamponata correttamente con una copertura uniforme del batterio su tutto l’agar.
- Dopo aver tamponato completamente la piastra, girarla di 90 gradi e ripetere il processo di tamponamento. (Non è necessario inumidire nuovamente il tampone.) Eseguire il tampone intorno alla circonferenza della piastra prima di gettarlo nell’apposito sacchetto.
- Lasciare asciugare la superficie per circa 5 minuti prima di posizionare i dischi antibiotici sull’agar.
- I DISCHI ANTIBIOTICI:
- Si utilizzano distributori di antibiotici individuali.
-
 Probabilmente dovrai usare un paio di pinze per rimuovere un disco antibiotico dal distributore: le pinze devono essere sterili. Mettete le pinze nell’alcool, fiammeggiate le pinze fino a quando prendono fuoco, lasciate che la fiamma si spenga—-pinze sterili.
Probabilmente dovrai usare un paio di pinze per rimuovere un disco antibiotico dal distributore: le pinze devono essere sterili. Mettete le pinze nell’alcool, fiammeggiate le pinze fino a quando prendono fuoco, lasciate che la fiamma si spenga—-pinze sterili. - Toccate leggermente ogni disco con il vostro anello inoculante sterile per assicurarvi che sia in buon contatto con la superficie dell’agar. Incubare a testa in giù e incubare a 37o C.
INTERPRETAZIONE
-
 Posizionare il righello metrico attraverso la zona di inibizione, al diametro più largo, e misurare da un bordo della zona all’altro. Tenere la lastra alla luce potrebbe essere d’aiuto.
Posizionare il righello metrico attraverso la zona di inibizione, al diametro più largo, e misurare da un bordo della zona all’altro. Tenere la lastra alla luce potrebbe essere d’aiuto. - Utilizzare misure millimetriche. Il diametro del disco sarà parte di quel numero.
- Se non c’è nessuna zona, riportalo come 0–anche se il disco stesso è di circa 7 mm.
- Il diametro della zona è riportato in millimetri, cercato sul grafico, e il risultato riportato come sensibile, resistente o intermedio.
- Registra i risultati per la tua tabella, così come le altre tabelle, nella tabella.
|
Antibiotico (agente antimicrobico) |
DISC CODICE |
Resistente (< o = mm) |
Intermedio (mm) |
Suscettibile (= o > mm) |
|
|---|---|---|---|---|---|
| Amoxicillina (altro) | AMC | <13 | 14-17 | mm)” style=”text-allineare:centro;” class=”lt-bio-3483″>>18 | |
| Amoxicillina (Staph) | AMC | 19 | mm)” style=”text-allineare:centro;” class=”lt-bio-3483″>20 | ||
| Ampicillina (altro) | AM | 11 | 12-13 | mm)” style=”text-allineare:centro;” class=”lt-bio-3483″>14 | |
| Ampicillina (Staph) | AM | 28 | mm)” style=”text-allineare:centro;” class=”lt-bio-3483″>29 | ||
| Carbenicillina (altro) | CB | 17 | 18- | 17 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>23 |
| Carbenicillina (Pseudomonas) | CB | 13 | 14-16 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>17 | |
| Cefoxitin | FOX | 14 | 15-.17 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>18 | |
| Cephalothin | CF | 14 | 15-.17 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>18 | |
| Cloramfenicolo | C | 12 | 13-17 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>18 | |
| Ciprofloxacin | CIP-5 | 15 | 16-20 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>21 | |
| Clindamicina | CC-2 | 14 | 15-20 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>21 | |
| Enoxacin (Fluorochinolone, 2a generazione.) | ENX-10 | 14 | 15-17 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>18 | |
| Erthromycin | E | 13 | 14-.22 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>23 | |
| Gentamicina | GM | 12 | 13-.14 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>15 | |
| Kanamicina | K-30 | 13 | 14-17 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>18 | |
| Meticillina (Staph) | M(oDP) | 9 | 10-13 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>14 | |
| Oxacillina (Staph) | OX | 10 | 11-12 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>13 | |
| Penicillina G (Enterococco) | P | 14 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>15 | ||
| Penicillina G (Staph) | P | 28 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>29 | ||
| Streptomicina | S-10 | 14 | 15-20 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>21 | |
| Sulfamethoxazole-trimethoprim | SXT | 10 | 11-15 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>16 | |
| Tetraciclina | Te-…30 | 14 | 15-18 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>19 | |
| Tobramicina | NN-.10 | 12 | 13-14 | mm)” style=”text-align:centro;” class=”lt-bio-3483″>15 | |
| Vancomicina | Va-30 | 9 | 10-11 | mm)” style=”text-align:center;” class=”lt-bio-3483″>12 |
Tabella dei risultati
Registra i risultati dei 5 batteri con tutti gli antibiotici.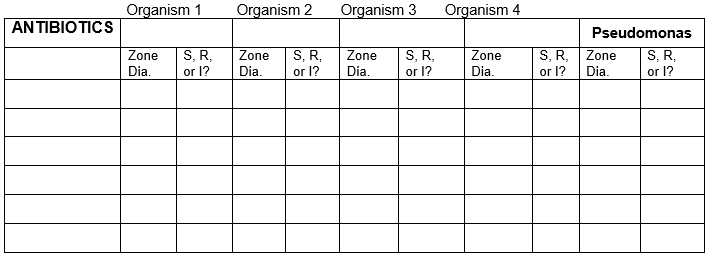
Diametro della zona in unità millimetriche. Usa la tabella per sensibile, resistente o intermedio
QUESTIONS
- Più grande è la dimensione della zona, più ____________ il batterio è a quell’antibiotico.
- Quali unità di misura sono usate per misurare le dimensioni della zona?
- Come si confronta la sensibilità dello Staph con quella dello Pseudomonas?
Contribuenti
-
Jackie Reynolds, professore di biologia (Richland College)