Legami covalenti singoli
Il legame covalente più semplice si forma tra due atomi di idrogeno. Ogni atomo di idrogeno ha un singolo elettrone, e ognuno ha bisogno di due elettroni per un guscio esterno completo. La molecola di idrogeno, \ce{H_2}, consiste in due atomi di idrogeno che condividono i loro due elettroni di valenza. L’idrogeno può anche formare legami covalenti con altri atomi. Per esempio, l’idrogeno e il cloro hanno bisogno ciascuno di un elettrone in più per raggiungere la configurazione di gas nobile. Condividendo gli elettroni di valenza (ogni atomo ne dona uno), si forma la molecola stabile \(\ce{HCl}).
Useremo una rappresentazione semplificata dei legami covalenti nota come strutture di Lewis. Questi disegni sono anche conosciuti con vari altri nomi, tra cui strutture a punti di Lewis o strutture a punti di elettroni. Ogni punto nella struttura rappresenta un elettrone di valenza nel composto. Per esempio, \(\ce{H_2}) potrebbe essere disegnato come \(\ce{H} : \ce{H}). Ogni punto rappresenta un elettrone di valenza, e il fatto che siano posizionati tra i due atomi significa che sono condivisi per un legame covalente. Per molecole più grandi, può diventare ingombrante disegnare tutti gli elettroni di valenza, quindi una coppia di elettroni di legame può anche essere disegnata come una linea retta. Così, \(\ce{H_2}) può anche essere rappresentato come \(\ce{H-H}).
Se volessimo mostrare la struttura di Lewis del \ce{HCl}, disegneremmo quanto segue:

Si può vedere che il legame covalente consiste di due elettroni tra il \ce{H} e il \ce{Cl}. Il \ce{H} ha un guscio esterno completo di due elettroni e il cloro ha un guscio esterno completo di otto elettroni. I legami covalenti con altri alogeni possono essere scritti allo stesso modo.
Tipi simili di strutture di Lewis possono essere scritti per altre molecole che formano legami covalenti. Molti composti che contengono \(\ce{O}}), \ce{N}, \ce{C}, \ce{S}, e \ce{P} sono tenuti insieme da legami covalenti. Il numero di legami covalenti che un atomo formerà può generalmente essere previsto dal numero di elettroni che un atomo richiede per riempire il suo guscio di valenza. Per esempio, l’ossigeno ha 6 elettroni nel suo guscio esterno e ha bisogno di altri due per riempire questo guscio, quindi formerà solo due legami covalenti con altri atomi. Se guardiamo la molecola dell’acqua \(\sinistra( \ce{H_2O} destra)\) (vedi figura sotto), vediamo che l’atomo di ossigeno fa due legami totali (uno con ogni atomo di idrogeno).
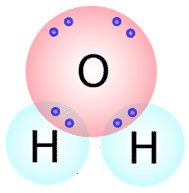
Come potete vedere, ci sono due coppie di elettroni non coinvolte nel legame covalente. Queste coppie di elettroni non legati sono note come coppie solitarie e contribuiscono alla forma complessiva della molecola. Allo stesso modo, l’azoto ha bisogno di tre elettroni per completare il suo guscio di valenza, quindi tende a fare tre legami covalenti, con una coppia solitaria di elettroni non legati lasciata in sospeso.
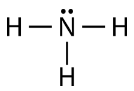
Ancora una volta, ciascuna delle linee rappresenta una coppia di elettroni di legame (un singolo legame), e la coppia solitaria di azoto è disegnata come due punti.