Obiettivi di apprendimento
- Descrivere la relazione tra la concentrazione del soluto e le proprietà fisiche di una soluzione.
- Capire che il numero totale di particelle non volatili del soluto determina la diminuzione della pressione di vapore, l’aumento del punto di ebollizione e la diminuzione del punto di congelamento di una soluzione rispetto al solvente puro.
La pressione osmotica è una proprietà colligativa delle soluzioni che si osserva usando una membrana semipermeabile, una barriera con pori abbastanza piccoli da permettere il passaggio di molecole di solvente ma non di molecole di soluto o ioni. Il flusso netto di solvente attraverso una membrana semipermeabile è chiamato osmosi (dal greco osmós, che significa “spingere”). La direzione del flusso netto di solvente è sempre dal lato con la concentrazione più bassa di soluto al lato con la concentrazione più alta.
L’osmosi può essere dimostrata usando un tubo a U come quello mostrato nella figura \(\PageIndex{1}), che contiene acqua pura nel braccio sinistro e una soluzione acquosa diluita di glucosio nel braccio destro. Si verifica un flusso netto di acqua attraverso la membrana fino a quando i livelli nei bracci smettono di cambiare, il che indica che è stato raggiunto l’equilibrio. La pressione osmotica (\(\Pi\)) della soluzione di glucosio è la differenza di pressione tra i due lati, in questo caso le altezze delle due colonne. Anche se la membrana semipermeabile permette alle molecole d’acqua di passare in entrambe le direzioni, la velocità del flusso non è la stessa in entrambe le direzioni perché la concentrazione di acqua non è la stessa nei due bracci. Il flusso netto di acqua attraverso la membrana può essere impedito applicando una pressione al braccio destro che è uguale alla pressione osmotica della soluzione di glucosio.
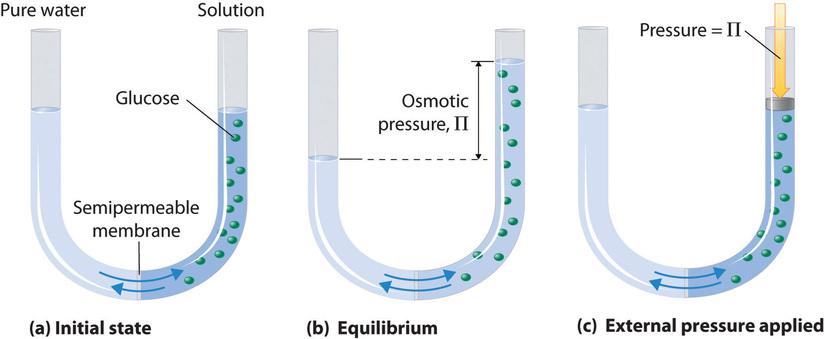
La pressione osmotica di una soluzione dipende dalla concentrazione delle particelle di soluto disciolte. La pressione osmotica obbedisce a una legge che assomiglia all’equazione dei gas ideali:
dove
- \(M\) è il numero di moli di soluto per unità di volume di soluzione (cioè, la molarità della soluzione),
- (R) è la costante dei gas ideali, e
- (T) è la temperatura assoluta.
Come mostrato nell’Esempio \(\PageIndex{1}), le pressioni osmotiche tendono ad essere abbastanza alte, anche per soluzioni piuttosto diluite.
Esempio \(\PageIndex{1}): Cellule di lievito
Quando sono poste in una soluzione salina concentrata, alcuni lieviti sono in grado di produrre alte concentrazioni interne di glicerolo per contrastare la pressione osmotica del mezzo circostante. Supponiamo che le cellule di lievito siano poste in una soluzione acquosa contenente il 4,0% di \(NaCl\) in massa; la densità della soluzione è 1,02 g/mL a 25°C.
Calcolate la pressione osmotica di una soluzione acquosa di \(NaCl\) al 4,0% a 25°C.
Se la normale pressione osmotica all’interno di una cellula di lievito è di 7,3 atm, corrispondente a una concentrazione totale di particelle disciolte di 0,30 M, quale concentrazione di glicerolo devono sintetizzare le cellule per equilibrare esattamente la pressione osmotica esterna a 25°C?
Dati: concentrazione, densità e temperatura della soluzione \(NaCl\); pressione osmotica interna della cellula
Chiesto: pressione osmotica della soluzione \(NaCl\) e concentrazione di glicerolo necessaria
Strategia:
- Calcolare la molarità della soluzione \(NaCl\) usando la massa formula del soluto e la densità della soluzione. Poi calcola la concentrazione totale delle particelle disciolte.
- Usa l’equazione \ref{eq1} per calcolare la pressione osmotica della soluzione.
- Sottrai la normale pressione osmotica delle cellule dalla pressione osmotica della soluzione salina per ottenere la pressione aggiuntiva necessaria per bilanciare le due. Usa l’equazione \ref{eq1} per calcolare la molarità del glicerolo necessaria per creare questa pressione osmotica.
Soluzione:
A La soluzione contiene 4,0 g di \(NaCl\) per 100 g di soluzione. Usando la massa formula di \(NaCl\) (58,44 g/mol) e la densità della soluzione (1,02 g/mL), possiamo calcolare la molarità:
&===frazione(\dfrac{4,0 \; \cancel{g};NaCl}{58.44; \cancel{g}/mol; NaCl}}destra)\sinistra(\dfrac{1}{100}; \cancel{g};soluzione}}destra)\sinistra(\dfrac{1.02\; \cancel{g; soluzione}{1.00; soluzione}destra)\sinistra(\dfrac{1000\; \cancel{mL}{1}; L}destra) \nonumero \ &= 0.70\; M; NaCl \non numero \end{align}
Perché 1 mol di \(NaCl\) produce 2 mol di particelle in soluzione, la concentrazione totale di particelle disciolte nella soluzione è (2)(0.70 M) = 1,4 M.
B Ora possiamo usare l’equazione \ref{eq1} per calcolare la pressione osmotica della soluzione:
&=(1.4 \mol/L)\sinistra (298\; K) \\ &= 34 \ atm \end{align*}}]
C Se le cellule di lievito devono bilanciare esattamente la pressione osmotica esterna, devono produrre abbastanza glicerolo per dare un’ulteriore pressione interna di (34 atm – 7.3 atm) = 27 atm. Il glicerolo è un non elettrolita, quindi possiamo risolvere l’equazione \ref{eq1} per la molarità corrispondente a questa pressione osmotica:
\ &= \dfrac{27\; \cancel{atm}{ (298 \;\cancel{K})} &= 1.1 \M;glicerolo \end{align*}}]
Nella risoluzione di questo problema, avremmo anche potuto riconoscere che l’unico modo in cui le pressioni osmotiche possono essere uguali all’interno delle cellule e nella soluzione è se le concentrazioni delle particelle disciolte sono le stesse. Ci è stato dato che la concentrazione normale di particelle disciolte nelle cellule è 0,3 M, e abbiamo calcolato che la soluzione \(NaCl\) è effettivamente 1,4 M in particelle disciolte. Le cellule di lievito devono quindi sintetizzare abbastanza glicerolo per aumentare la concentrazione interna di particelle disciolte da 0,3 M a 1,4 M – cioè una concentrazione aggiuntiva di glicerolo di 1,1 M.
Esercizio \(\PageIndex{1}\)
Assumiamo che i fluidi all’interno di una salsiccia siano approssimativamente 0,80 M in particelle disciolte a causa del sale e del nitrito di sodio usati per prepararla. Calcola la pressione osmotica all’interno della salsiccia a 100°C per capire perché i cuochi esperti bucano la pelle semipermeabile delle salsicce prima di bollirle.
Risposta: 24 atm
A causa della grande grandezza delle pressioni osmotiche, l’osmosi è straordinariamente importante in biochimica, biologia e medicina. Praticamente ogni barriera che separa un organismo o una cellula dal suo ambiente si comporta come una membrana semipermeabile, permettendo il flusso di acqua ma non di soluti. Lo stesso vale per i compartimenti all’interno di un organismo o di una cellula. Alcune barriere specializzate, come quelle nei reni, sono leggermente più permeabili e usano un processo correlato chiamato dialisi, che permette il passaggio di acqua e piccole molecole, ma non di grandi molecole come le proteine.
Lo stesso principio è stato usato a lungo per conservare la frutta e le sue vitamine essenziali durante il lungo inverno. Nelle marmellate e nelle gelatine si usano alte concentrazioni di zucchero non solo per la dolcezza, ma perché aumentano notevolmente la pressione osmotica. Così tutti i batteri non uccisi nel processo di cottura sono disidratati, il che impedisce loro di moltiplicarsi in un mezzo altrimenti ricco di crescita batterica. Un processo simile usando il sale impedisce ai batteri di crescere nel prosciutto, nella pancetta, nel maiale salato, nel baccalà e in altre carni conservate. L’effetto della pressione osmotica è drammaticamente illustrato nella figura \(\PageIndex{2}), che mostra cosa succede quando i globuli rossi sono posti in una soluzione la cui pressione osmotica è molto più bassa o molto più alta della pressione interna delle cellule.

Oltre all’azione capillare, gli alberi usano la pressione osmotica per trasportare acqua e altri nutrienti dalle radici ai rami superiori. L’evaporazione dell’acqua dalle foglie provoca un aumento locale della concentrazione di sale, che genera una pressione osmotica che tira l’acqua su per il tronco dell’albero fino alle foglie.
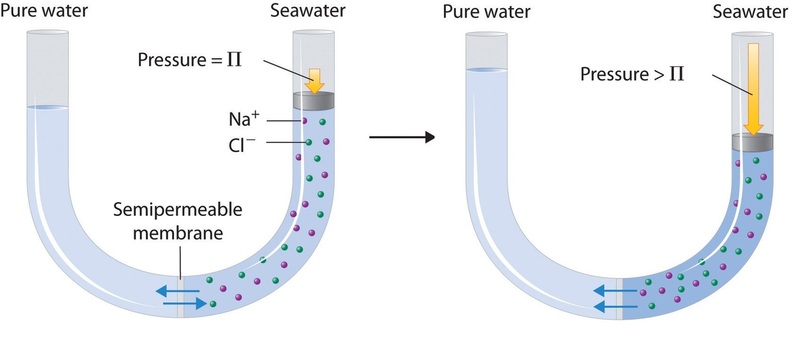
Infine, un processo chiamato osmosi inversa può essere usato per produrre acqua pura da acqua di mare. Come mostrato schematicamente nella figura (\PageIndex{3}), l’applicazione di un’alta pressione all’acqua di mare costringe le molecole d’acqua a fluire attraverso una membrana semipermeabile che separa l’acqua pura dalla soluzione, lasciando il sale disciolto. Impianti di desalinizzazione su larga scala che possono produrre centinaia di migliaia di galloni di acqua dolce al giorno sono comuni nelle terre desertiche del Medio Oriente, dove forniscono gran parte dell’acqua dolce necessaria alla popolazione. Impianti simili vengono ora utilizzati per fornire acqua dolce nel sud della California. Piccole unità di osmosi inversa azionate a mano possono produrre circa 5 L di acqua dolce all’ora, abbastanza per mantenere in vita 25 persone, e sono ora attrezzature standard sulle scialuppe di salvataggio della marina statunitense.
Sommario
Quando una soluzione e un solvente puro sono separati da una membrana semipermeabile, una barriera che lascia passare le molecole di solvente ma non quelle di soluto, il flusso di solvente in direzioni opposte è disuguale e produce una pressione osmotica, che è la differenza di pressione tra i due lati della membrana. L’osmosi è il flusso netto di solvente attraverso tale membrana a causa delle diverse concentrazioni di soluto. La dialisi utilizza una membrana semipermeabile con pori che lasciano passare solo piccole molecole di soluto e molecole di solvente.