
Keywords:
amorf,kristal
Glas op moleculair niveau
We hebben het af en toe over glas als we het over polymeren hebben, vooral als we het over composietmaterialen hebben. Glasvezels worden vaak gebruikt om polymeren te versterken. Maar wat is dat spul dat glas heet? We gebruiken het natuurlijk vaak in combinatie met polymeren, maar is glas zelf een polymeer?
Voordat we die vraag behandelen, kijken we eerst eens wat glas is. De hoogste kwaliteit glas heeft de chemische formule SiO2. Maar dat is misleidend. Die formule doet denken aan kleine moleculen siliciumdioxide, vergelijkbaar met moleculen koolstofdioxide. Maar kleine siliciumdioxidemoleculen bestaan niet.

 In plaats daarvan wordt SiO2 in de natuur vaak aangetroffen als een kristallijne vaste stof, met een structuur zoals je die hiernaast ziet. Elk siliciumatoom is gebonden aan vier zuurstofatomen, tetraëdervormig natuurlijk; en elk zuurstofatoom is gebonden aan twee siliciumatomen. Als SiO2 in deze kristallijne vorm is, noemen we het silica. Je hebt silica eerder gezien. Als je er grote kristallen van vindt, noemen we het kwarts. Als we er een heleboel kleine kristallen van hebben, noemen we het zand.
In plaats daarvan wordt SiO2 in de natuur vaak aangetroffen als een kristallijne vaste stof, met een structuur zoals je die hiernaast ziet. Elk siliciumatoom is gebonden aan vier zuurstofatomen, tetraëdervormig natuurlijk; en elk zuurstofatoom is gebonden aan twee siliciumatomen. Als SiO2 in deze kristallijne vorm is, noemen we het silica. Je hebt silica eerder gezien. Als je er grote kristallen van vindt, noemen we het kwarts. Als we er een heleboel kleine kristallen van hebben, noemen we het zand.
Maar dit silica is geen glas. We moeten er eerst iets mee doen om er glas van te maken. We moeten het verhitten tot het smelt, en dan heel snel weer afkoelen. Als het smelt, breken de silicium- en zuurstofatomen uit hun kristalstructuur. Als we het langzaam zouden afkoelen, zouden de atomen zich langzaam weer in hun kristalstructuur rangschikken naarmate ze langzamer afkoelen. (Denk eraan, warmte is eigenlijk gewoon de willekeurige beweging van atomen en moleculen. Hete atomen bewegen veel, koude atomen heel weinig.)
Maar als we het snel genoeg afkoelen, worden de atomen van het kiezelzuur als het ware in hun spoor tegengehouden. Ze hebben geen tijd om zich op te stellen, en ze zullen vastzitten in elke oude opstelling. Ze zien er dan ongeveer zo uit:v
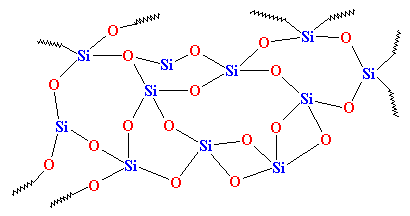
Zoals je ziet, is er geen orde in de ordening van de atomen. Dit soort materialen noemen we amorf. Dit is het glas dat wordt gebruikt voor telescoop lenzen en dergelijke dingen. Het heeft zeer goede optische eigenschappen, maar het is broos. Voor dagelijks gebruik hebben we iets stevigers nodig. Het meeste glas wordt gemaakt van zand, en wanneer we het zand smelten, voegen we meestal wat natriumcarbonaat toe. Hierdoor krijgen we een taaier glas met een structuur die er als volgt uitziet:
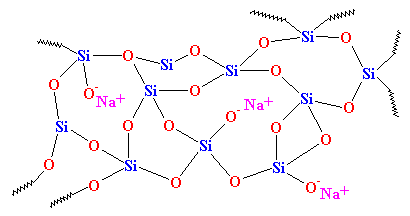
Dit is het glas dat je elke dag ziet, in potten en ramen, en het is het glas dat wordt gebruikt in composieten. Vroeger werd het zelfs “sodaglas” genoemd om het van kwarts te onderscheiden.
Dus, is dit een polymeer of niet? Gewoonlijk wordt het niet als zodanig beschouwd. Waarom niet? Sommigen zeggen dat het anorganisch is, en polymeren zijn meestal organisch. Maar er zijn veel anorganische polymeren. Wat dacht u bijvoorbeeld van polysiloxanen? Deze lineaire, en ja, anorganische materialen hebben een structuur die erg lijkt op die van glas, en ze worden beschouwd als polymeren. Kijk eens naar een polysiloxaan:
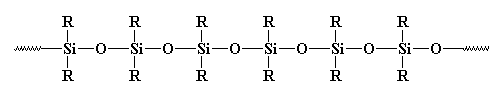
Dus hoe zit het met crosslinking?
In zekere zin kan glas worden beschouwd als een sterk crosslinked polysiloxaan. Maar meestal denken we er niet zo over. Waarom niet? Waarschijnlijk omdat je zelfs in een sterk vernet systeem nog de polymeerketen kunt volgen en zien waar de crosslinks zitten. Maar met glas is dat moeilijk te doen.
Hier is een vergelijking die dit punt illustreert: koolstofvezels en koolstofnanobuisjes. Doe er wat diamant bij om de familie compleet te maken. “Welke familie?” vraagt u. Gewoon die van koolstof gebonden aan andere koolstof in een twee- of driedimensionale array, en NIET gebonden aan iets anders. Zuivere koolstof!
Waarom is volledig vernette koolstof geen polymeer?
Bedenk nu dat koolstof echt aan vier andere atomen gebonden wil zijn. Meestal zijn dit vier verschillende andere atomen, maar meerdere bindingen aan hetzelfde atoom tellen ook. Dat is waar de meeste vinylmonomeren om de hoek komen kijken: ze hebben een dubbele koolstof-koolstof binding, wat betekent dat elke koolstof in het vinyl slechts aan twee andere atomen kan worden gebonden naast de koolstof aan het andere eind van de dubbele binding: vier bindingen in totaal.
Nu komt het interessante gedeelte. In grafeen, koolstofvezels en koolstofnanobuisjes zijn de koolstofatomen ENKEL gebonden aan andere koolstofatomen. In deze verbindingen heeft elke koolstof echter een combinatie van dubbele en enkele bindingen, wat zorgt voor een sterk gedelokaliseerde set moleculaire banen. Dat betekent dat deze materialen elektronen geleiden en dat ze elektrisch geleidend zijn. Interessant experiment: stop een stel koolstofvezels in een magnetron en geef er een zap op: vlammen en rook als de elektronen die in het materiaal rondgaan, reageren met zuurstof en in rook opgaan!
Diamant is nog interessanter, omdat het het hardste materiaal is dat we kennen. Waarom is het zo hard, maar toch doorzichtig en in staat om licht zo mooi te breken? Het is gewoon pure koolstof, maar met een addertje onder het gras: elke koolstof heeft nu vier enkelvoudige bindingen met vier andere koolstofatomen. Deze perfect symmetrische reeks koolstofatomen heeft een perfecte reeks bindingen in vier verschillende richtingen. “Beter dan dit wordt het niet,” zou je zeggen.
Worden deze volledig-koolstofnetwerken dan als polymeren beschouwd? Nee, en wel om dezelfde reden waarom glas dat niet is. Het komt allemaal neer op conventie en geschiedenis. Sinds we hebben ontdekt hoe een organisch polymeer er eigenlijk uitziet, passen glas en diamant daar gewoon niet bij. Vooroordeel, zo u wilt, want ze voldoen wel aan de eis van een volledig vernet polymeer. Oh, nou ja, andere gevechten te vechten…
 |
Terug naar Level Three Directory |
 |
Keer terug naar Directory Macrogalleria |