Pourquoi les atomes se lient-ils les uns aux autres ?
Les atomes se lient les uns aux autres afin de pouvoir diminuer leur énergie et devenir stables. Et lorsque les atomes se lient à d’autres atomes, ils fabriquent souvent des molécules aux propriétés chimiques et physiques uniques. Utilisons le modèle ci-dessous pour expliquer comment les atomes se lient pour devenir stables.
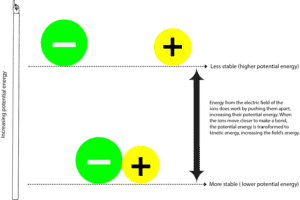
Lorsque l’atome chargé négativement (anion) et l’atome chargé positivement (cation) forment une liaison, ils sont généralement plus stables avec une énergie potentielle plus faible. L’énergie potentielle est l’énergie due aux positions relatives de ces ions dans le champ électrique qui les entoure. Le champ électrique est une zone dans laquelle s’exerce une force. D’une certaine manière, un champ électrique est similaire à un champ magnétique. Et vous pouvez voir ces lignes de force entourant un magnétique lorsque vous étalez de la limaille de fer autour de lui.
Pour séparer l’ion négatif de l’ion positif, le champ électrique entourant les ions doit faire un travail en écartant ces ions. Lorsque le champ électrique fait cela, il transfère également de l’énergie à ces particules, augmentant ainsi leur énergie potentielle. Vous pouvez comparer ce processus au fait de tirer deux aimants qui s’attirent l’un l’autre. Dans ce cas, vous êtes le champ de force qui fournit l’énergie nécessaire pour les séparer, et lorsque vous les séparez, les aimants augmentent leur énergie potentielle. Et comme ils doivent faire plus d’efforts pour s’éloigner l’un de l’autre, ils deviennent instables. Dès que tu lâches prise, les deux aimants sont rapidement attirés l’un vers l’autre, ce qui diminue leur énergie potentielle. Maintenant,
où est passé le reste de l’énergie potentielle ?
Cette énergie a été retransmise à toi et à ton environnement sous forme d’énergie cinétique. L’énergie cinétique est l’énergie qu’un objet possède lorsqu’il se déplace, et nous ressentons souvent cette énergie sous forme de chaleur. Ainsi, chaque fois que vous ressentez de la chaleur, cela signifie que l’énergie se déplace d’un endroit plus chaud vers un endroit plus froid. Ou, en d’autres termes, d’une source plus concentrée vers une source moins concentrée. Gardez à l’esprit que l’énergie ne peut jamais être transférée dans l’autre sens – d’un endroit plus froid à un endroit plus chaud.
Donc, lorsque l’énergie est transférée depuis et vers le champ ou depuis et vers l’univers, nous disons généralement que l’énergie est conservée. Ce qui signifie que nous ne pouvons pas créer ou détruire l’énergie, nous pouvons seulement la convertir d’une forme à une autre. C’est-à-dire de l’énergie potentielle à l’énergie cinétique et de l’énergie cinétique à l’énergie potentielle.
Qu’utilisent les atomes pour se lier à d’autres atomes ?
Les atomes utilisent leurs électrons de valence pour se lier à d’autres atomes. Et pour que les atomes se lient, ils doivent faire au moins l’une des choses suivantes ;
- gagner des électrons d’autres atomes
- perdre des électrons à d’autres atomes
- partager des électrons avec d’autres atomes
Et rappelez-vous que les électrons de valence occupent l’orbitale la plus énergétique d’un atome. Et vous pouvez visualiser ces électrons lorsque vous écrivez la configuration électronique d’un atome. Si vous le faites avec les éléments du groupe principal de la première et de la deuxième période, vous remarquerez que l’hydrogène a un électron de valence, l’azote en a 5, l’oxygène en a 6 et le néon en a 8.
Si nous dessinons ces électrons de valence en mettant un ou des points en haut, à droite, en bas et à gauche de leurs symboles chimiques, nous obtiendrons ces diagrammes simples appelés diagrammes de Lewis, nommés en l’honneur de Lewis, qui a été le premier à les utiliser pour expliquer l’idée de liaison. Maintenant, approfondissons la question de la liaison avec les structures de Lewis suivantes :
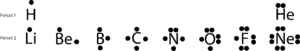
Si vous regardez les éléments de la deuxième période, vous remarquerez que seul le Néon (Ne) possède deux électrons sur chacun de ses quatre côtés. Si vous additionnez tous les électrons sur les quatre côtés, vous découvrirez qu’il y a huit électrons qui l’entourent.
Le nombre huit est lié au dernier chiffre du numéro de groupe auquel appartient Ne, le groupe 18. Ce groupe spécial d’éléments, appelé les gaz nobles, a tendance à être stable et non réactif dans des conditions normales. À l’exception de l’hélium, ils ont tous huit électrons de valence dans le groupe.
En raison de leur comportement chimique, Lewis a pu déduire que pour que les autres éléments atteignent une configuration stable comme les gaz nobles, ils doivent réagir avec d’autres atomes pour y parvenir. A partir de cette conclusion, Lewis a proposé la règle de l’octuor. La règle des huit.
Mais il y a des exceptions, comme vous pouvez le constater, l’hydrogène n’a besoin que de deux électrons pour atteindre une configuration stable similaire à celle de He. Malgré cela et d’autres lacunes, les structures en points de Lewis peuvent expliquer comment les atomes se lient de manière simple sans que nous ayons à dessiner des orbitales atomiques complexes.
Qu’est-ce qui fait que les atomes se lient avec d’autres atomes ?
L’énergie ! L’énergie est généralement la force motrice de la liaison. Pour que les atomes se lient, ils doivent trouver un équilibre délicat entre les forces d’attraction et de répulsion de leurs noyaux et de leurs électrons. Pour apprendre comment deux atomes d’hydrogène partagent des électrons pour créer la molécule d’hydrogène, cliquez ici.
.