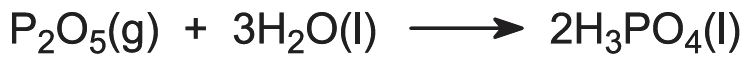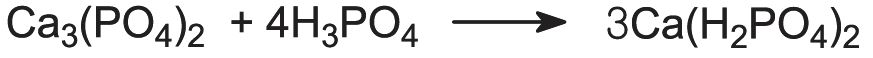Utilisations de l’acide phosphorique
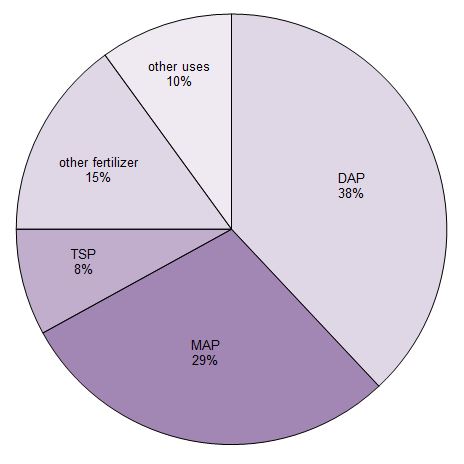
Environ 90% de l’acide phosphorique produit est utilisé pour fabriquer des engrais. Il est principalement transformé en trois sels de phosphate qui sont utilisés comme engrais. Il s’agit du superphosphate triple (TSP), de l’hydrogénophosphate de diamonium (DAP) et du dihydrogénophosphate de monoammonium (MAP).
Figure 1 Utilisations de l’acide phosphorique.
Données de Potash Corporation, 2014
Les phosphates sont également utilisés de diverses autres façons, notamment dans les boissons gazeuses et comme supplément dans les aliments donnés aux bovins, aux porcs et aux volailles.
Bien que leur utilisation comme adjuvants dans les détergents ait été progressivement abandonnée dans de nombreux pays, il s’agit toujours d’une utilisation importante de l’acide dans certains pays.
Production annuelle d’acide phosphorique
| Monde | 43 millions de tonnes1,2,3 |
| Chine | 17 millions de tonnes4 |
| Asie du Sud-Est et du Nord-est (y compris l’Indonésie et le Japon) |
10 millions de tonnes4 | US | 8.4 millions de tonnes5 |
1 Potash Corporation, 2014
2 JDCPhosphate, 2014
3 Estimation pour 2016
4 Extrapolation à partir des données, IHS,Markit, 2015
5 2015 Business of Chemistry, American Chemistry Council, 2016
Fabrication de l’acide phosphorique
L’acide phosphorique est fabriqué par deux procédés :
a) le procédé ‘humide’
b) le procédé thermique
La méthode thermique donne normalement un produit plus concentré et plus pur, mais elle est énergivore (en raison de la fabrication du phosphore lui-même. L’acide produit par la voie « humide » est moins pur mais est utilisé dans la fabrication d’engrais.
(a) voie humide
L’acide phosphorique est produit à partir de la fluorapatite, connue sous le nom de roche phosphatée, 3Ca3(PO4)2.CaF2, par l’ajout d’acide sulfurique concentré (93%) dans une série de réacteurs bien agités. On obtient ainsi de l’acide phosphorique et du sulfate de calcium (gypse) ainsi que d’autres impuretés insolubles. On ajoute de l’eau et le gypse est éliminé par filtration avec d’autres matières insolubles (par exemple, la silice). Le fluorure, sous forme de H2SiF6, est éliminé à un stade ultérieur par évaporation.
Bien que la réaction se déroule par étapes impliquant le dihydrogénophosphate de calcium, la réaction globale peut être représentée comme :
Cependant, il existe des réactions secondaires ; par exemple avec le fluorure de calcium et le carbonate de calcium présents dans la roche :


L’acide fluorosilicilique est un sous-produit important de cette opération et de la fabrication du fluorure d’hydrogène. Il peut être neutralisé avec de l’hydroxyde de sodium pour former de l’hexafluorosilicate de sodium. Cet acide est également utilisé pour fabriquer du fluorure d’aluminium, utilisé à son tour dans la fabrication de l’aluminium.
La structure cristalline du sulfate de calcium formé dépend des conditions de la réaction. À 340-350 K, le produit principal est le dihydrate, CaSO4.2H2O. A 360-380 K, on obtient l’hémihydrate, CaSO4.1/2H2O.
Le sulfate de calcium est filtré et l’acide est ensuite concentré à environ 56% de P2O5 par distillation sous vide.
Le produit de l’acide « par voie humide » est impur mais peut être utilisé, sans autre purification, pour la fabrication d’engrais (voir ci-dessous). Alternativement, il peut être évaporé davantage pour obtenir ca 70% P2O5, une solution appelée acide superphosphorique qui est utilisée directement comme fertrilisateur liquide.
Pour fabriquer des phosphates industriels, l’acide est purifié par extraction par solvant en utilisant, par exemple, de la méthyl isobutyl cétone (MIBK) dans laquelle l’acide est légèrement soluble et concentrée pour donner une teneur de 60% P2O5. Cet acide peut être encore purifié en utilisant des solvants pour l’extraire des métaux lourds et défluoré (par évaporation) pour obtenir un produit de qualité alimentaire.
B) Procédé thermique
Les matières premières de ce procédé sont le phosphore et l’air:
Dans un premier temps, le phosphore est pulvérisé dans le four et est brûlé à l’air à environ 1800-3000 K.
La plupart des procédés utilisent de l’air non séché et beaucoup impliquent l’ajout de vapeur au brûleur de phosphore pour produire et maintenir un film d’acides polyphosphoriques condensés qui protègent la tour du brûleur en acier inoxydable (refroidie par eau à l’extérieur). Les produits de la tour du brûleur passent directement dans une tour d’hydratation où l’oxyde de phosphore gazeux est absorbé dans de l’acide phosphorique recyclé :
Alternativement, le phosphore peut être brûlé à l’air sec. Le pentoxyde de phosphore est condensé sous forme de poudre blanche et hydraté séparément en acide phosphorique.
Cette méthode permet de récupérer et de réutiliser la chaleur.
La combustion et l’hydratation directe, telles que décrites précédemment, créent des conditions hautement corrosives. Les équipements sont construits en acier inoxydable ou sont revêtus de briques de carbone. Pour réduire la corrosion, les parois des tours du brûleur et de l’hydrateur sont refroidies, mais les produits du réacteur émergent à une température trop basse pour une récupération de chaleur utile.
L’acide produit a une concentration d’environ 85%.
L’acide tétraphosphorique, l’un des membres d’une famille d’acides polyphosphoriques qui peuvent être produits sélectivement, est fabriqué soit en faisant bouillir l’eau à haute température dans un récipient en carbone, soit en ajoutant du pentoxyde de phosphore solide à de l’acide phosphorique presque bouillant. La première méthode donne généralement le produit le plus pur, en raison de la forte teneur en arsenic du pentoxyde de phosphore.
Phosphates
Les sels de l’acide phosphorique, les phosphates, sont les composés largement utilisés en agriculture, dans l’industrie et à la maison.
(a) Les phosphates d’ammonium
Le dihydrogénophosphate de monoammonium et l’hydrogénophosphate de diammonium sont très utilisés comme engrais et sont fabriqués en mélangeant les bonnes proportions d’acide phosphorique avec de l’ammoniac anhydre dans un tambour rotatif.
Le choix du phosphate d’ammonium à utiliser dépend de la proportion d’azote et de phosphore nécessaire à la culture.
(b) Les phosphates de calcium
Les phosphates de calcium sont très utilisés comme engrais. Le dihydrogénophosphate de calcium, Ca(H2PO4)2, est produit par la réaction de la roche phosphatée avec l’acide sulfurique :
Ce produit est connu sous le nom de superphosphate. Il contient environ 20 % de P2O5.
Si la roche phosphatée est traitée à l’acide phosphorique, plutôt qu’à l’acide sulfurique, on obtient une forme plus concentrée de dihydrogénophosphate de calcium avec un taux de P2O5 globalement plus élevé (50 %) :
C’est ce qu’on appelle le triple superphosphate. Le niveau plus élevé de phosphate est obtenu parce que le produit n’est plus dilué avec du sulfate de calcium.
(c) Phosphates de sodium
Les phosphates de sodium sont produits par la réaction de l’acide phosphorique et d’une solution concentrée d’hydroxyde de sodium dans les proportions appropriées (stœchiométriques). Le produit se cristallise.
- Le dihydrogénophosphate monosodique (MSP, NaH2PO4) est utilisé dans les formulations de nettoyage des métaux et de préparation des surfaces, comme source de phosphate dans la fabrication de produits pharmaceutiques, et comme agent de contrôle du pH dans les dentifrices, dans le revêtement en émail vitreux (articles sanitaires) et dans la fabrication de phosphates d’amidon. L’une des utilisations les plus importantes est le traitement de la plomberie dans l’eau potable. L’acide phosphorique ou le MSP peuvent être utilisés pour produire un mince revêtement insoluble de phosphate de plomb sur les tuyaux de plomb afin d’empêcher la dissolution du plomb par les acides présents dans l’eau.
- L’hydrogénophosphate disodique (Na2HPO4) est utilisé comme agent adoucissant dans le fromage fondu, dans les émaux et les glaçures céramiques, dans le tannage du cuir, dans la fabrication de teintures et comme inhibiteur de corrosion dans le traitement de l’eau.
- Le phosphate trisodique (Na3PO4) est utilisé dans les nettoyants à usage intensif, par exemple pour dégraisser l’acier. C’est un alcali et un séquestrant pour les ions calcium, les maintenant en solution et empêchant la formation d’une écume.
- Le pyrophosphate disodique (Na2H2P2O7) est utilisé comme agent levant dans le pain/les gâteaux (il aide à la libération du dioxyde de carbone à partir du bicarbonate de soude), comme suppresseur d’oxyde de fer (effet de noircissement ou de brunissement) dans la fabrication de divers aliments et comme dispersant dans les boues de forage de puits de pétrole.