Find sources : « Liaison pi » – actualités – journaux – livres – érudit – JSTOR (février 2013) (Learn how and when to remove this template message)
En chimie, les liaisons pi (liaisons π) sont des liaisons chimiques covalentes où deux lobes d’une orbitale sur un atome recouvrent deux lobes d’une orbitale sur un autre atome et ce recouvrement se produit latéralement. Chacune de ces orbitales atomiques a une densité électronique nulle au niveau d’un plan nodal partagé, passant par les deux noyaux liés. Ce même plan est également un plan nodal pour l’orbitale moléculaire de la liaison pi. Les liaisons pi peuvent se former dans les liaisons doubles et triples mais ne se forment pas dans les liaisons simples dans la plupart des cas.
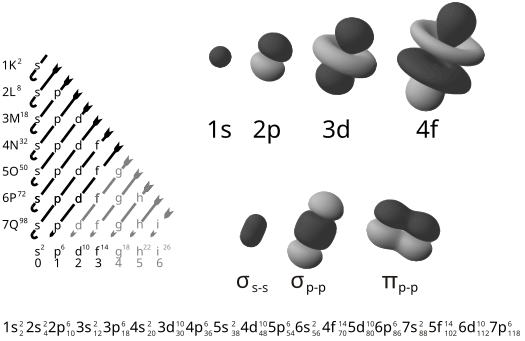

La lettre grecque π dans leur nom fait référence aux orbitales p, puisque la symétrie orbitale de la liaison pi est la même que celle de l’orbitale p lorsqu’elle est vue dans l’axe de la liaison. Une forme courante de ce type de liaison implique les orbitales p elles-mêmes, bien que les orbitales d s’engagent également dans la liaison pi. Ce dernier mode constitue une partie de la base de la liaison multiple métal-métal.

Les liaisons pi sont généralement plus faibles que les liaisons sigma. La double liaison C-C, composée d’une liaison sigma et d’une liaison pi, a une énergie de liaison inférieure au double de celle d’une liaison simple C-C, ce qui indique que la stabilité ajoutée par la liaison pi est inférieure à la stabilité d’une liaison sigma. Du point de vue de la mécanique quantique, la faiblesse de cette liaison s’explique par un chevauchement nettement moindre entre les orbitales p qui la composent, en raison de leur orientation parallèle. Ceci est contrasté par les liaisons sigma qui forment des orbitales de liaison directement entre les noyaux des atomes liants, ce qui entraîne un plus grand chevauchement et une liaison sigma forte.
Les liaisons Pi résultent du chevauchement d’orbitales atomiques qui sont en contact à travers deux zones de chevauchement. Les liaisons pi sont des liaisons plus diffuses que les liaisons sigma. Les électrons des liaisons pi sont parfois appelés électrons pi. Les fragments moléculaires reliés par une liaison pi ne peuvent pas tourner autour de cette liaison sans rompre la liaison pi, car la rotation implique la destruction de l’orientation parallèle des orbitales p constitutives.