
Mots-clés:
amorphe,cristal
Le verre au niveau moléculaire
Nous parlons de verre de temps en temps lorsque nous abordons les polymères, notamment lorsqu’il s’agit de matériaux composites. Les fibres de verre sont souvent utilisées pour renforcer les polymères. Mais qu’est-ce que ce matériau appelé verre ? Nous l’utilisons beaucoup avec les polymères, évidemment, mais le verre est-il lui-même un polymère ?
Avant d’aborder cette question, voyons ce qu’est le verre. Le verre de la meilleure qualité a pour formule chimique SiO2. Mais cette formule est trompeuse. Cette formule évoque des idées de petites molécules de dioxyde de silicium, analogues aux molécules de dioxyde de carbone. Mais les petites molécules de dioxyde de silicium n’existent pas.

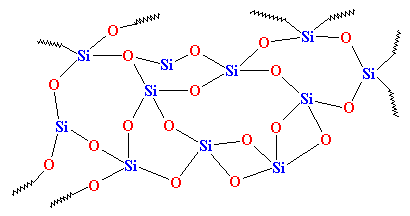
 Au contraire, dans la nature, le SiO2 se présente souvent sous la forme d’un solide cristallin, avec une structure comme celle que vous voyez sur votre droite. Chaque atome de silicium est lié à quatre atomes d’oxygène, en tétraèdre, bien sûr, et chaque atome d’oxygène est lié à deux atomes de silicium. Lorsque le SiO2 est sous cette forme cristalline, nous l’appelons silice. Vous avez déjà vu de la silice. Lorsque vous trouvez de gros cristaux, nous l’appelons quartz. Quand on en a plein de petits cristaux minuscules, on l’appelle du sable.
Au contraire, dans la nature, le SiO2 se présente souvent sous la forme d’un solide cristallin, avec une structure comme celle que vous voyez sur votre droite. Chaque atome de silicium est lié à quatre atomes d’oxygène, en tétraèdre, bien sûr, et chaque atome d’oxygène est lié à deux atomes de silicium. Lorsque le SiO2 est sous cette forme cristalline, nous l’appelons silice. Vous avez déjà vu de la silice. Lorsque vous trouvez de gros cristaux, nous l’appelons quartz. Quand on en a plein de petits cristaux minuscules, on l’appelle du sable.
Mais cette silice n’est pas du verre. Nous devons d’abord lui faire quelque chose pour la transformer en verre. Nous devons la chauffer jusqu’à ce qu’elle fonde, puis la refroidir très rapidement. Quand elle fond, les atomes de silicium et d’oxygène se détachent de leur structure cristalline. Si on le refroidissait lentement, les atomes se remettraient lentement dans leur disposition cristalline en ralentissant. (N’oubliez pas que la chaleur n’est en fait que le mouvement aléatoire des atomes et des molécules. Les atomes chauds bougent beaucoup, les atomes froids bougent très peu.)
Mais si nous la refroidissons assez rapidement, les atomes de la silice seront arrêtés dans leur élan, pour ainsi dire. Ils n’auront pas le temps de s’aligner, et ils seront coincés dans n’importe quel arrangement. Ils ressembleront à quelque chose comme ceci:v
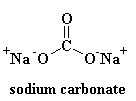
Comme vous pouvez le voir, il n’y a pas d’ordre dans la disposition des atomes. Nous appelons les matériaux comme celui-ci amorphes. C’est le verre qui est utilisé pour les lentilles des télescopes et autres. Il possède de très bonnes propriétés optiques, mais il est fragile. Pour les usages quotidiens, nous avons besoin d’un matériau plus résistant. La plupart des verres sont fabriqués à partir de sable, et lorsque nous faisons fondre le sable, nous ajoutons généralement du carbonate de sodium. Cela nous donne un verre plus résistant dont la structure ressemble à ceci :
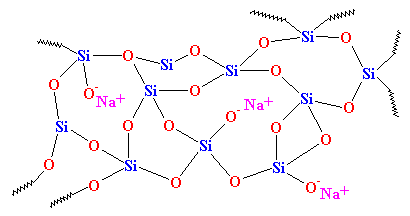
C’est le verre que vous voyez tous les jours, dans les bocaux et les fenêtres, et c’est le verre utilisé dans les composites. D’ailleurs, on l’appelait autrefois « verre sodé » pour le distinguer du quartz.
Alors, est-ce un polymère ou non ? Généralement, il n’est pas considéré comme tel. Pourquoi ? Certains diront que c’est inorganique, et que les polymères sont généralement organiques. Mais il existe de nombreux polymères inorganiques. Par exemple, qu’en est-il des polysiloxanes ? Ces matériaux linéaires, et oui, inorganiques, ont une structure très similaire à celle du verre et sont considérés comme des polymères. Jetez un coup d’œil à un polysiloxane :
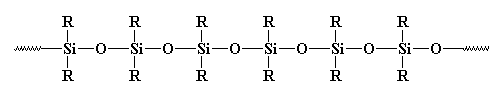
So What About Crosslinking?
Dans un sens, le verre pourrait être considéré comme un polysiloxane hautement réticulé. Mais nous n’y pensons généralement pas de cette façon. Pourquoi ? Probablement parce que même dans un système hautement réticulé, vous pouvez toujours tracer une chaîne de polymère et voir où se trouvent les réticulations. Mais avec le verre, ce serait difficile de le faire.
Voici une comparaison qui illustre ce point : les fibres de carbone et les nanotubes de carbone. Ajoutez-y un peu de diamant pour que cette famille soit complète. « Quelle famille ? », demandez-vous. Tout simplement celle du carbone lié à d’autres carbones dans un réseau bidimensionnel ou tridimensionnel, et NON lié à autre chose. Du carbone pur !
Pourquoi le carbone complètement réticulé n’est-il pas un polymère ?
Souvenez-vous maintenant que le carbone veut vraiment être lié à quatre autres atomes. Habituellement, ce sont quatre autres atomes distincts, mais les liaisons multiples avec le même atome comptent aussi. C’est là que la plupart des monomères vinyliques entrent en jeu : ils ont une double liaison carbone-carbone, ce qui signifie que chaque carbone du vinyle ne peut être lié qu’à deux autres atomes en plus du carbone à l’autre extrémité de la double liaison : quatre liaisons au total.
Voici la partie intéressante. Dans le graphène, les fibres de carbone et les nanotubes de carbone, les carbones sont UNIQUEMENT liés à d’autres atomes de carbone. Dans ces composés, cependant, chaque carbone a une combinaison de liaisons doubles et simples, ce qui donne un ensemble d’orbites moléculaires hautement délocalisées. Cela signifie que ces matériaux conduisent les électrons et qu’ils sont électriquement conducteurs. Expérience intéressante : mettez un tas de fibres de carbone dans un micro-ondes et zappez-le : flammes et fumée car les électrons qui se déplacent dans le matériau réagissent avec l’oxygène et partent en fumée !
Le diamant est encore plus intéressant, étant le matériau le plus dur connu. Pourquoi est-il si dur, tout en étant transparent et capable de réfracter la lumière de façon si magnifique ? Ce n’est que du carbone pur, après tout, mais avec un hic : désormais, chaque carbone a quatre liaisons simples avec quatre autres atomes de carbone. Cet ensemble parfaitement symétrique de carbones possède un ensemble parfait de liaisons allant dans quatre directions différentes. « On ne peut pas faire mieux », pourriez-vous dire.
Alors, ces réseaux tout-carbone sont-ils pensés comme des polymères ? Non, et pour la même raison que le verre ne l’est pas. Tout est affaire de convention et d’histoire. Depuis que l’on a compris à quoi ressemblait réellement un polymère organique, le verre et le diamant n’avaient tout simplement pas leur place. Un préjugé, si vous voulez, puisqu’ils répondent aux exigences d’un polymère complètement réticulé. Oh, eh bien, d’autres batailles à mener…
 |
Retour au répertoire du niveau trois |
 |
Retour au répertoire Macrogalleria |