Introduction
La bronchopneumopathie chronique obstructive (BPCO) est une affection pulmonaire grave, qui évolue lentement et a des répercussions systémiques ; elle touche principalement les personnes de plus de 40 ans.1 Cependant, la BPCO est évitable et traitable. De nombreux patients connaissent des exacerbations de la BPCO et certaines d’entre elles nécessitent des visites aux urgences et des hospitalisations. Au Portugal, et bien que les hospitalisations dues à la BPCO entre 2009 et 2016 aient diminué de 8%, elles représentaient encore 8049 patients hospitalisés en 2016. Les hospitalisations de patients âgés de 80 ans ou plus ont augmenté de 28,4% en 2005 à 38,0% en 2014, reflétant une population vieillissante,2 avec potentiellement plus de comorbidités.
La prise en charge appropriée des exacerbations de la BPCO représente un défi clinique important.3 Dans 70% à 80% des exacerbations de la BPCO, le facteur précipitant est une infection des voies respiratoires,4 mais dans environ un tiers des exacerbations sévères de la BPCO, une cause ne peut être identifiée,1 ce qui entrave une orientation adéquate de la stratégie thérapeutique. Il existe plusieurs outils diagnostiques pour évaluer une exacerbation et sa gravité, ce qui aidera à décider si le patient peut être pris en charge à domicile ou dans un établissement de soins primaires ou s’il doit être envoyé aux urgences et éventuellement hospitalisé.1,5-7 La gravité d’une exacerbation déterminera son traitement,1,7,8 et des scores pronostiques doivent être utilisés pour prédire le risque d’une future exacerbation. Trois scores pronostiques ont été proposés sur la base des caractéristiques biologiques et cliniques des exacerbations : le score BAP-65,9 le score DeCOPD9 et le score proposé par Roche et al.10,11
Après une prise en charge appropriée d’une exacerbation, un plan de sortie adapté doit être préparé. Celui-ci dépendra de la gravité de l’exacerbation, mais doit généralement inclure la reclassification du patient selon les critères GOLD,1 l’optimisation du traitement pharmacologique,1,4,8 la prise en charge des comorbidités, l’éducation du patient (ou de l’aidant à domicile) sur l’utilisation correcte des médicaments,1,8 l’orientation vers une consultation de pneumologie s’il n’en fréquente pas déjà une, et un programme d’arrêt du tabac et de réadaptation pulmonaire.
ExacerbationsDéfinition, causes et étiologieDéfinition
À l’heure actuelle, il n’existe pas de définition exacte ou cohérente d’une exacerbation de la BPCO. La définition de l’exacerbation dans la mise à jour 2016 de GOLD12, » un événement aigu caractérisé par une aggravation des symptômes respiratoires du patient qui va au-delà des variations normales quotidiennes et qui entraîne un changement de médicament « , a été simplifiée dans le document GOLD 201713 en » une aggravation aiguë des symptômes respiratoires qui entraîne un traitement supplémentaire « .
Causes et étiologie
Plusieurs facteurs pouvant conduire à une aggravation des symptômes ont été identifiés, et dans 70 à 80 % des cas d’exacerbation de la BPCO, le facteur précipitant est une infection des voies respiratoires4, virale4,9,14,15 ou bactérienne4,9,15, mais dans environ un tiers des exacerbations sévères de la BPCO, une cause ne peut être identifiée1.
Il est important d’identifier la cause sous-jacente d’une exacerbation car cela orientera la stratégie thérapeutique.
Classification
Comme pour l’absence de définition d’une exacerbation, il n’existe pas de système de classification consensuel pour évaluer la gravité de l’exacerbation, bien que certains aient été proposés16. Certains de ces scores seront discutés plus loin.
Dans les exacerbations légères, on observe une aggravation des symptômes qui peut être gérée à domicile, avec une augmentation de la posologie des médicaments habituels.1,6,17 Les exacerbations modérées ne répondent pas à une augmentation de la posologie des bronchodilatateurs et nécessitent donc un traitement par corticostéroïdes systémiques et/ou antibiotiques.1,6,17,18 Les exacerbations sévères nécessitent une hospitalisation ou une évaluation en urgence1,6,17,18 et ont un impact sévère sur l’activité physique. Les exacerbations très graves nécessitent une admission dans une unité de soins intensifs (USI)1 et ont un impact très important sur l’activité physique. Les exacerbations infectieuses se caractérisent par une augmentation du volume et de la purulence des expectorations associée à une aggravation de la dyspnée et doivent être traitées par antibiotiques.1,8
Outils diagnostiques
L’évaluation d’une exacerbation et de sa gravité repose sur les antécédents médicaux du patient,1,6 par exemple la limitation des débits aériens, la durée de l’aggravation des symptômes et le nombre d’épisodes précédents (total/hospitalisations). Les symptômes tels que l’essoufflement, la toux ou les expectorations7, les niveaux de saturation en oxygène7, les nouvelles limitations des activités quotidiennes6,7, les signes cliniques de gravité tels que l’utilisation des muscles respiratoires accessoires1,5, les mouvements paradoxaux de la paroi thoracique1,5, l’aggravation ou l’apparition d’une cyanose centrale1,7, le développement d’un œdème périphérique1,7, l’instabilité hémodynamique1, la détérioration de l’état mental1,6,7 et les comorbidités1 doivent tous être évalués. Une oxymétrie de pouls doit être effectuée sur tous les patients.6 Si un patient est dirigé vers un hôpital, les gaz du sang artériel doivent être mesurés5,6,8,15,19-21 et une radiographie pulmonaire doit être effectuée pour exclure les comorbidités et/ou d’autres maladies pulmonaires.1,6,8,15,19 Dans ces cas, il est également recommandé que les patients subissent un ECG,1,6,19,20 une numération globulaire,1,6,8,20-22 et des tests biochimiques de base, notamment des concentrations d’électrolytes,1,8,20,21 de l’urée,8 de la glycémie1,20 et un panel métabolique.6 Les taux de théophylline doivent être mesurés chez les patients sous traitement à la théophylline à l’admission et des hémocultures doivent être réalisées si le patient a de la fièvre.8 La culture des échantillons d’expectoration n’est pas recommandée en pratique courante, uniquement si les expectorations sont purulentes,8 et le document GOLD 2018 recommande la culture des expectorations et un test de sensibilité aux antibiotiques uniquement si une exacerbation infectieuse ne répond pas au traitement antibiotique empirique.1 Certains auteurs mentionnent la numération sanguine de l’éosinophilie comme une procédure conseillée pour guider le traitement des exacerbations de la BPCO, car il a été suggéré que les exacerbations éosinophiles peuvent mieux répondre aux stéroïdes systémiques.1,15 La spirométrie n’est pas recommandée pendant une exacerbation.1
Si l’exacerbation est sévère et le patient hospitalisé, les niveaux de peptide natriurétique cérébral et les mesures des enzymes cardiaques doivent être envisagés, en particulier si le patient ne répond pas au traitement conventionnel.6 Il convient également de rechercher des virus et des bactéries dans un écouvillon pharyngé ou dans les expectorations14,20,23 et de mesurer la protéine C-réactive sérique.14,20,24 La procalcitonine peut guider l’antibiothérapie car elle a été suggérée comme un marqueur plus spécifique des infections bactériennes et peut être utile pour décider de la prescription d’antibiotiques.1 L’indice de comorbidité de Charlson5,20,21,23, l’échelle de dyspnée modifiée du Medical Research Council (mMRC)5,20,21,23, l’activité physique5 et l’état de santé général5 doivent être évalués. Les auteurs ne conseillent pas l’utilisation systématique du score CAT23 (COPD Assessment Test) au Portugal car il n’est pas validé pour la population portugaise. Si le patient est admis en unité de soins intensifs, outre les tests recommandés dans les exacerbations sévères, l’échelle de coma de Glasgow5 doit être utilisée, les infections des voies respiratoires recherchées25 et une hémoculture réalisée.24 Selon le document GOLD 2018, seuls les patients nécessitant une ventilation non invasive (VNI) ou une ventilation invasive (IV) doivent être hospitalisés1.
Stratégies pharmacologiquesLABA+LAMA
Les β2 agonistes inhalés à courte durée d’action (SABA) et les antagonistes muscariniques à courte durée d’action (SAMA) restent le pilier du traitement des symptômes et de l’obstruction des flux d’air lors des exacerbations de la BPCO1,4,6. Bien qu’au moment de la publication du document GOLD 2018, aucune étude clinique n’ait évalué l’utilité des β2 agonistes à longue durée d’action (LABA) ou des antagonistes muscariniques à longue durée d’action (LAMA) lors des exacerbations, la recommandation est de poursuivre cette médication pendant l’exacerbation ou de la commencer dès que possible avant la sortie de l’hôpital1. L’association LABA+LAMA présente un avantage documenté dans la réduction des exacerbations lorsqu’elle est prescrite à des patients en phase stable de la BPCO26, en particulier l’association indacatérol/glycopyrronium, comme l’ont démontré les études SPARK27 et FLAME28. De plus, la récente étude FLAME28, première étude prospective évaluant l’éosinophilie sanguine comme biomarqueur de la réponse thérapeutique, a montré que l’association indacatérol/glycopyrronium permettait une amélioration significative de la fonction pulmonaire par rapport à l’association salmétérol/fluticasone pour tous les seuils analysés29. Une analyse post hoc récente de l’étude WISDOM a identifié un sous-groupe de patients – patients avec ≥2 exacerbations et ≥400 cellules/μL – qui semblent présenter un risque accru d’exacerbation lors de l’arrêt des CSI.30 En fait, et selon la version la plus récente du document GOLD,1 les patients symptomatiques en phase stable de la BPCO et ayant des antécédents de ≥2 exacerbations modérées, ou 1 avec admission à l’hôpital, au cours de la dernière année, peuvent bénéficier d’un CSI en plus des LABA/LAMA. Cependant, il reste à établir si les éosinophiles sanguins peuvent être utilisés comme biomarqueur pour prédire l’efficacité des CSI en termes de prévention des exacerbations, comme le suggère l’analyse post hoc WISDOM1.
Antibiotiques, corticostéroïdes et xanthines
Lors du traitement d’une exacerbation, il est recommandé d’ajouter des corticostéroïdes et/ou des antibiotiques par voie orale ou intraveineuse, en fonction de la gravité des symptômes et de la présence d’une infection.1,4,6-8,31 Les antibiotiques ne doivent être utilisés que pour le traitement des exacerbations infectieuses4,6,8,31 ou graves. Les documents GOLD 2018 et NHS 2014 recommandent l’administration d’antibiotiques aux patients atteints d’exacerbations de la MPOC qui présentent trois symptômes cardinaux – augmentation de la dyspnée, du volume des expectorations et de la purulence des expectorations7 (preuves B)1 ; qui présentent deux des symptômes cardinaux, si l’augmentation de la purulence des expectorations est l’un des deux symptômes7 (preuves C)1 ; ou qui nécessitent une ventilation mécanique (invasive ou non invasive) (preuves B).1
Il a été démontré que les antibiotiques réduisent le risque de mortalité à court terme, d’échec du traitement et de purulence des expectorations, et une étude menée chez des patients atteints de BPCO avec des exacerbations nécessitant une ventilation mécanique (invasive ou non invasive) a indiqué que le fait de ne pas traiter avec des antibiotiques était associé à une mortalité accrue et à une plus grande incidence de pneumonie nosocomiale secondaire1. Une revue Cochrane a conclu que l’administration d’antibiotiques lors d’exacerbations très sévères de la BPCO présentait des effets bénéfiques étendus et constants sur les résultats des patients admis dans une unité de soins intensifs,32 mais cette conclusion était basée sur les données d’une seule étude.32
Le protocole du NHS pour la prise en charge des exacerbations de la BPCO dans les soins primaires indique que les bronchodilatateurs et les corticostéroïdes constituent le pilier du traitement des exacerbations.7 Cependant, une revue systématique de 19 lignes directrices sur la BPCO a rapporté que les critères pour traiter les patients avec des antibiotiques étaient largement basés sur une augmentation des symptômes respiratoires, alors que les corticostéroïdes systémiques étaient souvent recommandés de manière universelle pour tous les patients souffrant d’exacerbations aiguës.33 Les auteurs ont également conclu que les lignes directrices actuelles sur la BPCO sont peu utiles pour identifier les patients souffrant d’exacerbations aiguës qui sont susceptibles de bénéficier d’un traitement par corticostéroïdes systémiques et par antibiotiques dans le cadre des soins primaires, ce qui pourrait contribuer à une utilisation excessive ou inappropriée de l’un ou l’autre traitement.
Certains biomarqueurs ont été suggérés comme utiles pour optimiser le traitement antibiotique. Le document GOLD 20181 ne recommande pas l’utilisation systématique de la CRP mais indique que plusieurs études ont suggéré que le traitement antibiotique guidé par la procalcitonine réduit l’exposition aux antibiotiques et les effets secondaires avec la même efficacité clinique. Cette observation est corroborée par une revue Cochrane démontrant que la procalcitonine peut guider l’antibiothérapie.32 En revanche, d’autres auteurs ont rapporté que la CRP pourrait être un marqueur plus valable,34 et une étude de soins primaires en vie réelle a conclu que la réalisation de tests rapides de CRP conduisait les médecins généralistes à prescrire moins d’antibiotiques que ceux qui ne le faisaient pas35.
Pour tous les patients, le choix de l’antibiotique doit être guidé par le schéma local de résistance bactérienne,1,8 l’histoire microbiologique du patient et ses facteurs de risque.
En général, le traitement empirique initial englobe l’aminopénicilline avec l’acide clavulanique, un macrolide ou une tétracycline.1,8 Cependant, l’utilisation à long terme des macrolides peut être associée à des effets secondaires importants et au risque de développer une résistance bactérienne.36 Les expectorations doivent être envoyées pour une culture (dans le cas de patients présentant des exacerbations fréquentes, une limitation sévère des flux d’air et/ou des exacerbations nécessitant une ventilation mécanique1), car des bactéries à Gram négatif (par exemple, des espèces de Pseudomonas) ou des agents pathogènes résistants qui ne sont pas sensibles aux antibiotiques mentionnés ci-dessus peuvent être présents1.
Bien que la durée la plus efficace du traitement reste à définir,32 la durée recommandée de l’antibiothérapie est généralement de 5 à 7 jours (preuve D)1 mais la durée du traitement dépendra de l’antibiotique utilisé.
La prise en charge des exacerbations en soins primaires doit inclure la maximisation du traitement par bronchodilatateurs et des corticostéroïdes systémiques s’ils ne sont pas contre-indiqués (30 mg de prednisolone) pendant 7 jours.1,7,8 Le traitement par prednisolone orale est tout aussi efficace que l’administration intraveineuse1. Le document GOLD 2018 recommande une dose de 40 mg de prednisone par jour pendant 5 jours1, tandis que le NICE 2016 recommande une dose de 30 mg pendant 7 à 14 jours, et recommande en outre qu’un traitement par corticostéroïdes ne soit pas supérieur à 14 jours, car un traitement prolongé ne présente aucun avantage8. Il a été démontré que l’utilisation de corticostéroïdes systémiques dans les exacerbations de la BPCO permet de raccourcir le temps de récupération, d’améliorer la fonction pulmonaire, d’améliorer l’oxygénation, de diminuer le risque de rechute précoce et d’échec du traitement, et de réduire la durée de l’hospitalisation.1
Une méta-analyse a confirmé que le taux de réussite du traitement augmentait avec les corticostéroïdes systémiques par rapport aux soins habituels des exacerbations de la BPCO. Les corticostéroïdes semblent être bénéfiques pour l’ensemble de la population en termes de taux de réussite du traitement.37
Certaines études suggèrent que les corticostéroïdes pourraient être moins efficaces dans le traitement des exacerbations aiguës de la BPCO chez les patients présentant des taux d’éosinophiles sanguins plus faibles15,38.
Concernant les méthylxanthines dans la prise en charge des exacerbations de la BPCO, les données actuelles ne soutiennent pas leur utilisation, étant donné que les effets bénéfiques possibles sur la fonction pulmonaire et les critères cliniques sont modestes et incohérents, tandis que les effets indésirables sont importants.1,4,6,31 Les méthylxanthines intraveineuses (théophylline ou aminophylline) peuvent être considérées comme un traitement de deuxième intention et utilisées en complément lorsque la réponse est insuffisante. Lors de l’utilisation de la théophylline, il est nécessaire de surveiller les taux sanguins, les effets secondaires et les interactions médicamenteuses potentielles.8,31
Therapeutique – stratification du risque
Les exacerbations de la BPCO peuvent être classées comme légères, modérées, sévères6 et très sévères. Les exacerbations très sévères nécessitent une admission en unité de soins intensifs, avec une ventilation invasive, et sortent du cadre de cet article.
Comme mentionné précédemment, les exacerbations de la BPCO sont très hétérogènes, ce qui rend particulièrement pertinent de déterminer leur étiologie, leur pathologie, leur gravité et leur risque, car tous ces facteurs auront des implications sur le pronostic, le traitement pharmacologique et le lieu du traitement.
En termes de traitement pharmacologique et de lieu de traitement, si les exacerbations sont légères et non infectieuses,1,4,7,8,31 elles peuvent être traitées à domicile avec une augmentation de la posologie des bronchodilatateurs d’entretien6,17. Si l’exacerbation est infectieuse4,8,31, un antibiotique doit être administré.1,7
Les exacerbations modérées doivent être traitées aux urgences et le patient doit ensuite quitter l’hôpital car ces exacerbations ne nécessitent pas d’hospitalisation, sauf si l’hospitalisation a lieu pour des raisons socio-économiques. La dose des bronchodilatateurs d’entretien doit être augmentée6,17 et le patient doit recevoir un corticostéroïde oral6,17,18 pendant 5 jours.1,38,39 Si l’exacerbation est infectieuse4,8,31, un antibiotique doit être administré.1,7
Dans le cas d’un patient qui a eu une exacerbation sévère, nécessitant une hospitalisation, le patient doit être reclassé comme exacerbateur fréquent. Habituellement, l’hospitalisation due à une exacerbation sévère nécessite une modification du traitement d’entretien inhalé comprenant de l’O2 si le patient est hypoxémique et une ventilation non invasive si le patient présente une hypercapnie, supérieure à 52cm H2O et/ou une acidémie,1,4,6,8 des corticostéroïdes oraux ou intraveineux (pendant 5 jours)1,38,39 et un antibiotique en cas d’infection,1,7 des xanthines en cas de réponse inadéquate au traitement4,8,16,31 et la prévention de la thromboembolie pulmonaire.
La sortie – plan d’action
Les patients présentant des exacerbations légères doivent être réévalués après trois mois, avec une spirométrie et une réévaluation du degré GOLD et, le cas échéant, une reclassification.
A la sortie d’une exacerbation modérée, la bronchodilatation doit être optimisée, la vaccination anti-pneumococcique doit être prescrite et un plan de sevrage tabagique et de réhabilitation respiratoire doit être préparé.
A la sortie d’une exacerbation sévère, un traitement d’entretien optimal1,4,8 par LABA, LAMA et CSI doit être prescrit. Les patients qui ont eu un épisode d’insuffisance respiratoire doivent avoir des résultats satisfaisants d’oxymétrie ou de gaz du sang artériel avant leur sortie. Les patients (ou les soignants à domicile) doivent recevoir des informations appropriées pour leur permettre de bien comprendre l’utilisation correcte des médicaments, y compris les inhalateurs et l’oxygène, et, si nécessaire, des dispositions doivent être prises pour le suivi et les soins à domicile (comme une infirmière visiteuse, la livraison d’oxygène, l’orientation vers un autre soutien). Le patient, son aidant et le médecin doivent être convaincus que le patient peut gérer avec succès le nouveau plan de traitement. En cas de doute sur la capacité du patient à gérer son traitement, une évaluation formelle des activités de la vie quotidienne peut être utile.8 Le document GOLD 2018 fournit une liste de critères de sortie.1 Pour les patients qui sont hypoxémiques pendant une exacerbation, les gaz du sang artériel et/ou l’oxymétrie de pouls doivent être évalués avant la sortie de l’hôpital et dans les 3 mois suivants. Si le patient reste hypoxémique, une oxygénothérapie supplémentaire à long terme peut être nécessaire.1 De plus, les patients doivent recevoir des instructions claires sur le moment et la manière d’arrêter leur traitement aux corticostéroïdes.1,8 En ce qui concerne la nécessité de soins individualisés, une étude canadienne dans laquelle les patients se voyaient proposer un appel téléphonique après leur sortie de l’hôpital, une visite à domicile et des soins continus a conclu que, bien qu’il n’y ait pas eu de réduction des taux de réadmission à 30 et 90 jours, une diminution de la mortalité totale à 90 jours a été observée. Ces données suggèrent que les soins individualisés entrepris dans cette étude peuvent avoir un impact sur la morbidité et la mortalité liées à la BPCO après une exacerbation aiguë.40 Tous les patients ayant subi une exacerbation sévère doivent être réévalués 4 à 6 semaines après leur sortie de l’hôpital,1 recevoir une prescription de vaccination anti-pneumococcique, et un plan de sevrage tabagique et de réhabilitation respiratoire doit être préparé – Fig. 1.
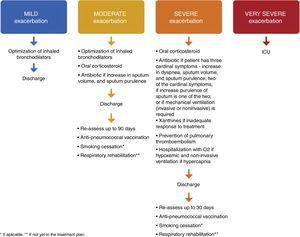
Traitement proposé, sortie et suivi des exacerbations légères, modérées, sévères et très sévères de la BPCO.
Les auteurs proposent de prescrire au patient un vaccin anti-pneumococcique 10 à 20 jours après sa sortie des urgences ou de l’hôpital.
Lors de la consultation de suivi (trois mois pour les exacerbations modérées et 4 à 6 semaines pour les exacerbations sévères), la spirométrie et les gaz du sang artériel doivent être mesurés. Les symptômes, l’utilisation correcte du traitement inhalé et la gestion adéquate des comorbidités doivent être réévalués. Le traitement pharmacologique doit être optimisé. Le plan de sevrage tabagique et de réhabilitation respiratoire doit être évalué. Une nouvelle consultation de suivi devrait être programmée dans les 30 à 60 jours suivants.
Conclusions
L’identification de la cause sous-jacente des exacerbations de la BPCO et l’évaluation de leur gravité sont fondamentales pour orienter le traitement. Après une prise en charge appropriée d’une exacerbation, il convient de préparer un plan de sortie adapté qui dépendra de sa gravité. Un plan de sortie approprié diminuera la charge des symptômes, contribuera à un rétablissement plus rapide, augmentera la qualité de vie du patient et préviendra ou retardera les exacerbations futures. L’orientation vers une consultation de pneumologie si le patient n’en fréquente pas déjà une est de la plus haute importance.
Conflits d’intérêts
AR déclare avoir reçu des honoraires de conférencier de la part d’AstraZeneca, Boehringer Ingelheim, Novartis, Bial, Medinfar, Mundipharma, Menarini, Grifols, Mylan, Tecnifar, Teva et cslbehring. CA déclare avoir reçu des honoraires de conférencier de AstraZeneca, Pfizer, Novartis et Mundipharma. SF ne déclare aucun conflit d’intérêt. JF déclare avoir reçu des honoraires de conférencier d’AstraZeneca, Boehringer Ingelheim, Diater, Inmunotek, Menarini, Mundipharma, Mylan, Tecnifar et TEVA, et participer aux conseils consultatifs de Bial, GSK et Novartis. MD déclare avoir reçu des honoraires pour des conférences de la part de AstraZeneca, Boehringher Ingelheim, Bial, GSK, Menarini et Novartis et pour sa participation aux conseils consultatifs de Bial, GSK et Novartis. Le CRC déclare des honoraires pour des exposés de Boehringer Ingelheim, Roche, Novartis, AstraZeneca, Pfizer vaccins, Teva, Menarini, Medinfar et Tecnifar, et la participation à des conseils consultatifs de Boehringer Ingelheim, Roche, Novartis, GSK, AstraZeneca et Pfizer vaccins.