Qu’est-ce que le spin de l’électron ?
Le spin de l’électron est une propriété quantique des électrons.C’est une forme de moment angulaire.La magnitude de ce moment angulaire est permanente.Comme la charge et la masse au repos, le spin est une propriété fondamentale et invariable de l’électron.

Comme méthode d’enseignement, les instructeurs comparent parfois le spin de l’électron à la terre qui tourne sur son axe toutes les 24 heures.Si l’électron tourne dans le sens des aiguilles d’une montre sur son axe, il est décrit comme un spin-up ; dans le sens inverse des aiguilles d’une montre, c’est un spin-down.C’est une explication commode, même si elle n’est pas entièrement justifiable mathématiquement.
Le moment angulaire de spin associé au spin de l’électron est indépendant du moment angulaire orbital, qui est associé au voyage de l’électron autour du noyau.
Le spin de l’électron n’est pas utilisé pour définir les coquilles, les sous-coquilles ou les orbitales des électrons, contrairement aux nombres quantiques n, l et ml.
Electron Spin vs the Electron Spin Quantum Number
Le spin électronique et le nombre quantique de spin électronique sont souvent traités comme une seule et même chose.Tous deux sont des nombres quantiques.Ce sont en fait des concepts différents, mais très étroitement liés.
– le spin de l’électron a pour symbole s
– le nombre quantique de spin de l’électron a pour symbole ms.
s
Le spin de l’électron, s, n’a qu’une seule valeur possible.Cette valeur est ½.Comme la masse au repos et la charge de l’électron, le spin ne varie pas.
ms
Contrairement à la masse et à la charge de l’électron, le spin a une orientation.L’orientation du spin est indiquée par le nombre quantique de spin, ms.
ms peut être positif ou négatif.
Diverses façons d’exprimer ms consistent à écrire :
– + ou –
– spin-up ou spin-down
–  ou
ou 
Par exemple, dans le schéma ci-dessous, l’hélium est dans son état fondamental électronique.
L’un de ses électrons est de spin-up, l’autre de spin-down. Ou encore, l’un de ses électrons a un spin positif, l’autre un spin négatif.
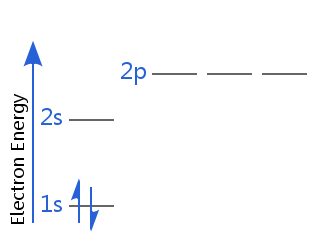
Il est habituel de dire que tout électron dans un atome est entièrement caractérisé par quatre nombres quantiques :
– n : le nombre quantique principal
– l : le nombre quantique de moment angulaire orbital
– ml : le nombre quantique magnétique
– ms : le nombre quantique de spin
Nous n’incluons pas s, car sa valeur ne varie pas. Elle est toujours égale à la moitié. Ainsi, la valeur du nombre quantique de spin, ms, s’écrit généralement comme ±½.
La découverte du spin de l’électron
Le spin intégré ou intrinsèque de l’électron a été détecté pour la première fois par Otto Stern et Walther Gerlach en 1922.Cependant, l’équation d’onde d’Erwin Schrödinger de 1926 ne le prenait pas en compte.
Wolfgang Pauli a réussi à introduire le spin de l’électron dans la mécanique ondulatoire comme un ajout.Trois nombres quantiques étaient déjà utilisés;l’introduction du spin par Pauli complétait l’image quantique de l’électron dans un atome d’hydrogène.
En 1928, la célèbre équation relativiste de Paul Dirac pour l’électron, l’équation de Dirac, a produit le spin électronique comme une conséquence naturelle de la physique quantique : le spin n’était plus un ajout.

.