Le cycle de vie d’une espèce de phytoplancton comprend quatre phases principales : la croissance (mitotique et asexuée), la sexualité (méiotique), la quiescence (un stade immobile sexuel ou asexué avec un faible taux métabolique qui est populairement appelé kyste) et la sénescence (déclin et mort de la population) (von Dassow et Montresor 2010). La plupart des dinoflagellés ont des cycles de vie haplontiques, ce qui signifie que le stade végétatif (celui qui subit la croissance) est haploïde.

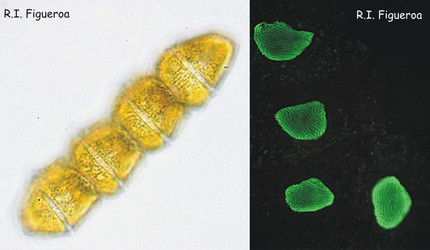
Fig. 1. Chaîne végétative de Gymnodinium catenatum (noyaux à droite). Les cellules se divisent par mitose en formant des chaînes comptant jusqu’à 64 cellules.
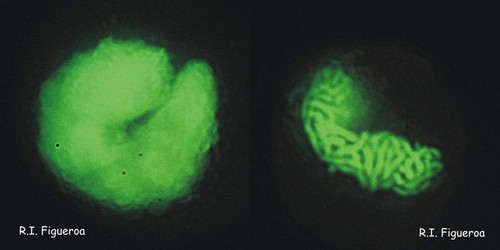
Fig. 2. Noyaux en forme de U dans les cellules végétatives d’Alexandrium taylori (à gauche) et d’Alexandrium minutum (à droite). ©
La reproduction asexuée peut se produire beaucoup plus rapidement et constitue donc le mode de reproduction prédominant dans des conditions environnementales optimales, mais la reproduction sexuée est essentielle pour l’adaptation et la survie des espèces car elle permet la recombinaison génétique (c’est-à-dire la variabilité génétique). Pendant la phase sexuelle, deux cellules haploïdes appelées gamètes fusionnent pour former un zygote mobile diploïde (planozygote) qui subira une méiose pour rétablir le stade végétatif.

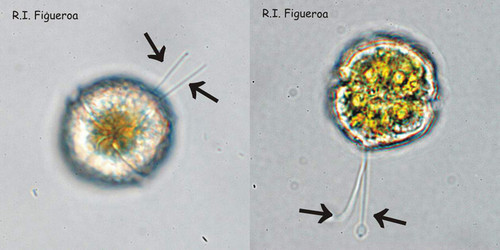
Fig. 3. Exemples de planozyotes, qui se caractérisent par deux flagelles longitudinaux (flèches) au lieu d’un seul, chez Alexandrium minutum (à gauche) et Alexandrium taylori (à droite). ©
La voie la plus courante rapportée jusqu’à très récemment était la transition du planozygote vers un stade quiescent, résistant à l’environnement, connu sous le nom de kyste de repos (un hypnozygote dormant non mobile avec une paroi épaisse). D’autres types de stades quiescents sont des kystes à paroi mince, moins aptes à résister à des conditions environnementales défavorables que les kystes de repos. Ces kystes – que l’on retrouve dans la bibliographie sous différents noms comme kyste temporal, pelliculaire ou ecdysal – peuvent être sexués ou asexués, ce dernier cas étant le moyen le plus rapide de produire un kyste.

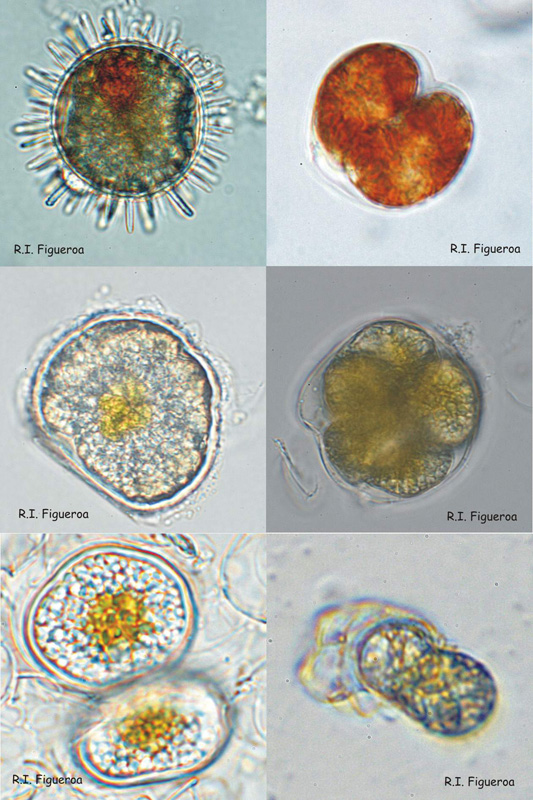
Fig. 4. Exemples de kystes au repos (sexuels) et pelliculaires (sexuels et asexués).
Rangée supérieure : Kystes sexuels au repos (à gauche) et asexués pelliculaires (à droite) chez Lingulodinium polyedrum.
Rangée du milieu : Kyste sexuel au repos (gauche) et kyste pelliculaire multiple également sexuel (droite) chez Alexandrium taylori.
Rangée du bas : Kyste sexuel au repos (à gauche) et kyste pelliculaire asexué (à droite) chez Alexandrium minutum.
©
Cependant, ce schéma général n’est pas toujours suivi, et les cycles de vie récemment rapportés se sont révélés bien plus complexes. Dans certaines espèces pour lesquelles le cycle sexuel a été rapporté, aucun kyste de repos n’est connu (par exemple Karlodinium veneficum), et la division du planozygote (méiose) a été documentée dans un nombre croissant d’autres espèces ; cela renforce donc l’idée que le planozygote peut sauter la formation du kyste (par exemple Figueroa et Bravo 2005a, b) et implique que la méiose peut se produire soit après la quiescence (kyste de repos ou pelliculaire), soit sans qu’il soit nécessaire de passer par une phase de quiescence. Chez certaines espèces de dinoflagellés, la méiose (dans les kystes de repos et chez les planozygotes) a été observée par un phénomène connu sous le nom de cyclosis nucléaire (par exemple, von Stosch 1972, 1973, Coats et al. 1984, Barlow et Triemer 1988). C’est un processus associé à la première division méiotique, qui consiste en un tourbillonnement des chromosomes à l’intérieur de l’enveloppe nucléaire (von Stosch 1972).
Les autres voies récemment découvertes au stade sexuel sont : (1) en culture, les gamètes peuvent revenir à une phase asexuée et subir une fission binaire (division asexuée) plutôt qu’une fusion (par exemple, Gymnodinium nolleri, G. catenatum, Alexandrium taylori ou Lingulodinium polyedrium) et (2) les planozygotes peuvent subir une méiose et une division sans la production d’un hypnozygote lorsqu’ils sont isolés individuellement et placés dans un milieu riche en nutriments, bien que le processus sexuel continue si l’isolement se fait dans un milieu pauvre en nutriments (Figueroa et Bravo, 2005a,b Figueroa et al, 2006a,b). Uchida (2001) n’a pas signalé de division planozygote, mais a constaté que les planozygotes ne s’enkystent pas si la densité cellulaire est inférieure à un certain seuil dans les espèces Scrippsiella trochoidea et Gyrodinium instriatum.
Mais quelle est la cause du passage d’un cycle asexué à un cycle sexuel ? Bien que les raisons soient principalement inconnues et nécessitent des études plus approfondies, il semble que des facteurs endogènes et environnementaux puissent être responsables de l’apparition de la sexualité, et que chaque espèce puisse avoir ses conditions de déclenchement spécifiques. La sexualité est traditionnellement obtenue en culture par épuisement des nutriments, la température et la lumière étant des modulateurs importants du rendement en kystes (Sgrosso et al. 2001, Nagai 2004). Cependant, l’appariement des gamètes et la formation de planozygotes dans la nature ne sont pas toujours liés à une pénurie de nutriments, étant donné que la sexualité a été observée soit à la fin des floraisons (Persson et al., 2008 ; Anderson et Wall, 1978) soit pendant la croissance active (Fukuyo, 2002), soit à l’atteinte d’un seuil d’abondance cellulaire (Garcés 2004).

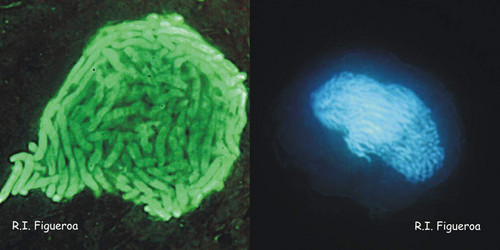
Fig. 5. Noyaux planozygotes chez Gymnodinium nolleri (à gauche) et Alexandrium minutum (à droite, en cours de méiose).
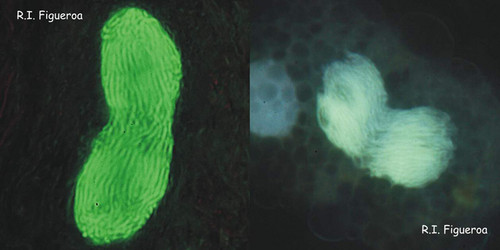
Fig. 6. Mitose dans les noyaux de Gymnodinium catenatum (à gauche) et Alexandrium margalefi (à droite). ©
Il existe deux systèmes d’accouplement de base chez les dinoflagellés, l’homothallisme et l’hétérothallisme, et les deux groupes ont des représentants isogames (les gamètes fusionnés sont semblables les uns aux autres) et anisogames (fusion de gamètes de tailles différentes).

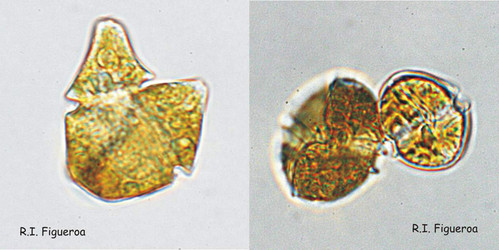
Fig. 7. Paires de gamètes isogames (à gauche, Gymnodinium nolleri) et anisogames (à droite, Alexandrium tamutum).
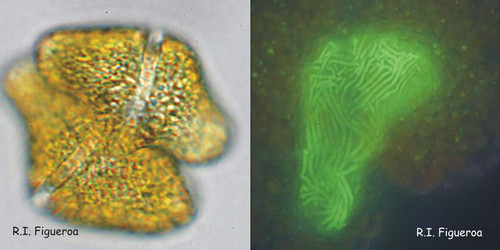
Fig. 8. Paire de gamètes en fusion chez Gymnodinium catenatum (gauche) et ses noyaux en cours de fusion. ©
En homothétie, les gamètes peuvent être génétiquement identiques. C’est le cas par exemple de l’espèce Alexandrium taylori (Giacobbe et Yang 1999). En hétérothérapie, des facteurs génétiquement déterminés dans les gamètes permettent de réussir l’accouplement, la fusion sexuelle et la méiose. Dans ce dernier cas, la compatibilité sexuelle peut comprendre seulement deux types d’accouplement différents (hétérothallisme simple), comme chez Lingulodinium polyedrum (Figueroa et Bravo 2005b) ou plus (hétérothallisme complexe), comme chez Alexandrium minutum (Figueroa et al. 2007). Ces définitions, lorsqu’elles sont appliquées aux espèces productrices de kystes (hypnozygotes) au repos, impliquent que la production de kystes et une descendance viable sont possibles au sein de clones d’espèces homothalliques (autofertiles), alors que deux souches clonales différentes sont nécessaires pour obtenir des kystes viables chez les espèces hétérothalliques (auto stériles). Cependant, différents systèmes d’accouplement peuvent exister au sein d’une même espèce, et par exemple un continuum entre homothallique et hétérothallique a été décrit chez l’espèce Gymnodinium catenatum (Figueroa et al. 2010).
Les différentes voies sexuelles et asexuées peuvent être résumées comme le montre le schéma suivant :

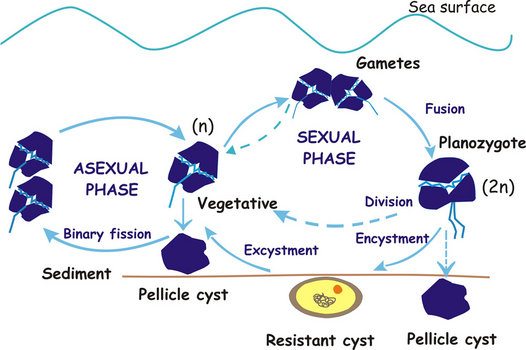
Fig. 9. Cycle de vie des dinoflagellés (modifié d’après Walker et al.1984). ©
Au moins 10 % de tous les dinoflagellés, et jusqu’à 28 % dans les zones tempérées, sont des producteurs de kystes au repos (Persson et al. 2000). On pense que la reproduction sexuée est essentielle à la survie saisonnière de ces espèces, bien que des kystes de repos asexués soient également connus chez Scrippsiella hangoei (Kremp et Parrow 2006). Les kystes de dinoflagellés dans les sédiments peuvent fournir l’inoculum pour de futures efflorescences après une longue période, étant donné qu’ils peuvent rester viables dans les sédiments jusqu’à 100 ans (Ribeiro et al. 2010). Un stade de vie hétéromorphe tel que le kyste peut représenter un avantage car il permet l’allocation de l’espèce dans différentes niches (planctonique et benthique), et parce que les différents stades de vie d’un même organisme interagissent généralement avec l’environnement de manière assez différente.
Dans de nombreuses espèces, les stades planctoniques ne sont qu’une phase éphémère du cycle de vie de l’organisme, la dispersion et la concentration des cellules dormantes non mobiles étant déterminées par les mêmes fonctions de forçage qui contrôlent la dynamique des particules passives dans l’eau et dans les sédiments. La dormance et la maturation des kystes au repos sont des processus biologiques essentiels pour la population de dinoflagellés. La période de dormance est un temps de maturation au cours duquel l’activité biologique (la croissance) est suspendue. La germination ne peut pas être induite pendant la dormance, mais lorsqu’elle est terminée, le kyste entre en quiescence, une période pendant laquelle la germination peut se produire si les conditions environnementales environnantes sont appropriées.
La durée des périodes de dormance et de quiescence peut affecter le moment des floraisons. La dormance peut durer de quelques heures à quelques jours ou mois et elle est spécifique à chaque espèce (par exemple, 50 jours pour Alexandrium taylori, 1 mois pour Alexandrium minutum ou seulement quelques jours pour Kryptoperidinium foliaceum).
Le contrôle génétique (endogène) de la dormance a été prouvé chez l’espèce Gymnodinium nolleri (Figueroa et al. 2006c), mais il existe aussi des modulateurs exogènes (abiotiques et physiologiques) et des horloges internes (rythmes endogènes). Par exemple, une horloge endogène circaannuelle avec une période moyenne de 11 mois a été observée dans des conditions environnementales constantes pour la germination des kystes de l’espèce Alexandrium spp. de l’est du Golfe du Maine (Matrai et al. 2005). Les schémas de germination (continus, sporadiques ou saisonniers) déterminent la stratégie de floraison de chaque espèce et la succession saisonnière des espèces. Une fois la germination effectuée, la taille de l’inoculum cellulaire, et donc les chances de devenir une efflorescence, seront influencées non seulement par le nombre de kystes en germination et leur taux de dispersion, mais aussi par leur viabilité (pourcentage de survie du total des cellules en germination et leur capacité à effectuer une méiose réussie), qui dépendra là encore de plusieurs facteurs physiologiques et abiotiques.