Les liaisons covalentes simples
La liaison covalente la plus simple est formée entre deux atomes d’hydrogène. Chaque atome d’hydrogène possède un électron unique, et chacun a besoin de deux électrons pour une coquille externe complète. La molécule d’hydrogène, \(\ce{H_2}\), est constituée de deux atomes d’hydrogène partageant leurs deux électrons de valence. L’hydrogène peut également former des liaisons covalentes avec d’autres atomes. Par exemple, l’hydrogène et le chlore ont chacun besoin d’un électron supplémentaire pour obtenir une configuration de gaz noble. En partageant les électrons de valence (chaque atome en donne un), la molécule stable \(\ce{HCl}\) est formée.
Nous utiliserons une représentation simplifiée des liaisons covalentes connue sous le nom de structures de Lewis. Ces dessins sont également connus sous divers autres noms, notamment les structures de points de Lewis ou les structures de points d’électrons. Chaque point de la structure représente un électron de valence dans le composé. Par exemple, \(\ce{H_2}\) pourrait être dessiné comme \(\ce{H} : \ce{H}\). Chaque point représente un électron de valence, et le fait qu’ils soient placés entre les deux atomes signifie qu’ils sont partagés par une liaison covalente. Pour les grandes molécules, il peut être difficile de dessiner tous les électrons de valence, c’est pourquoi une paire d’électrons de liaison peut également être dessinée sous forme de ligne droite. Ainsi, \(\ce{H_2}\) peut également être représenté comme \(\ce{H-H}\).
Si nous voulions montrer la structure de Lewis de \(\ce{HCl}\), nous dessinerions ce qui suit:

Nous pouvons voir que la liaison covalente est constituée de deux électrons entre le \(\ce{H}\) et le \(\ce{Cl}\). L’\(\ce{H}\) a une enveloppe extérieure complète de deux électrons et le chlore a une enveloppe extérieure complète de huit électrons. Les liaisons covalentes avec d’autres halogènes peuvent être écrites de la même manière.
Des types similaires de structures de Lewis peuvent être écrits pour d’autres molécules qui forment des liaisons covalentes. De nombreux composés contenant des \(\ce{O}\), \(\ce{N}\), \(\ce{C}\), \(\ce{S}\), et \(\ce{P}\) sont maintenus ensemble par des liaisons covalentes. Le nombre de liaisons covalentes qu’un atome formera peut généralement être prédit par le nombre d’électrons dont il a besoin pour remplir sa couche de valence. Par exemple, l’oxygène possède 6 électrons dans sa coquille externe et a besoin de deux électrons supplémentaires pour remplir cette coquille, il ne formera donc que deux liaisons covalentes avec d’autres atomes. Si nous observons la molécule d’eau \(\left( \ce{H_2O} \right)\) (voir la figure ci-dessous), nous voyons que l’atome d’oxygène établit deux liaisons totales (une avec chaque atome d’hydrogène).
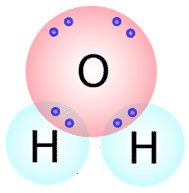
Comme vous pouvez le voir, il existe deux paires d’électrons non impliquées dans la liaison covalente. Ces paires d’électrons non liées sont appelées paires solitaires et contribuent à la forme globale de la molécule. De même, l’azote a besoin de trois électrons pour compléter sa coquille de valence, il a donc tendance à faire trois liaisons covalentes, et il lui reste une paire d’électrons solitaires non liés.
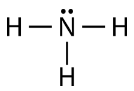
De nouveau, chacune des lignes représente une paire d’électrons de liaison (une seule liaison), et la paire solitaire de l’azote est dessinée sous la forme de deux points.