Objetivos de aprendizaje
Al finalizar esta sección, serás capaz de:
- Simbolizar la composición de las moléculas utilizando fórmulas moleculares y fórmulas empíricas
- Representar la disposición de enlace de los átomos dentro de las moléculas utilizando fórmulas estructurales
Una fórmula molecular es una representación de una molécula que utiliza símbolos químicos para indicar los tipos de átomos seguidos de subíndices para mostrar el número de átomos de cada tipo en la molécula. (El subíndice sólo se utiliza cuando hay más de un átomo de un tipo determinado). Las fórmulas moleculares también se utilizan como abreviaturas de los nombres de los compuestos.
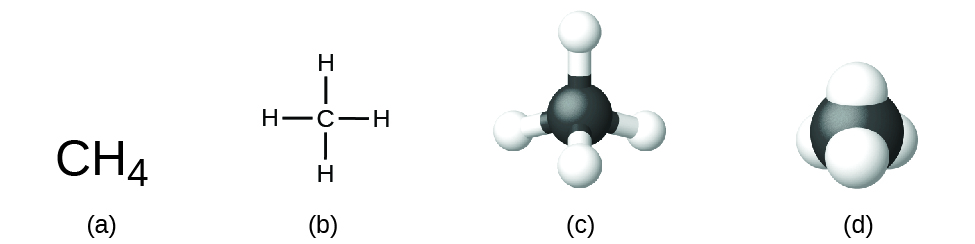
La fórmula estructural de un compuesto proporciona la misma información que su fórmula molecular (los tipos y números de átomos de la molécula) pero también muestra cómo están conectados los átomos en la molécula. La fórmula estructural del metano contiene símbolos para un átomo de C y cuatro átomos de H, lo que indica el número de átomos de la molécula (Figura 1). Las líneas representan los enlaces que mantienen unidos los átomos. (Un enlace químico es una atracción entre átomos o iones que los mantiene unidos en una molécula o un cristal). Más adelante hablaremos de los enlaces químicos y veremos cómo predecir la disposición de los átomos en una molécula. Por ahora, basta con saber que las líneas son una indicación de cómo están conectados los átomos en una molécula. Un modelo de bola y palo muestra la disposición geométrica de los átomos con tamaños atómicos no a escala, y un modelo de relleno de espacio muestra los tamaños relativos de los átomos.
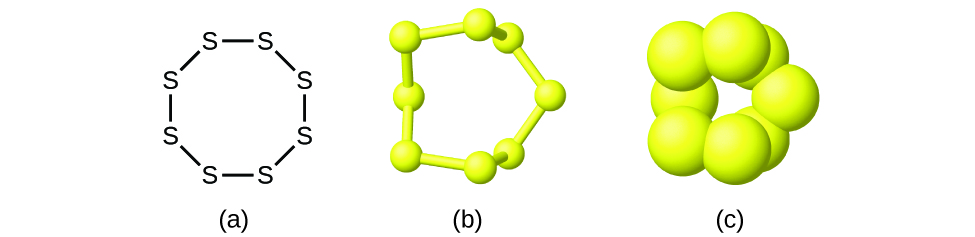
Aunque muchos elementos están formados por átomos individuales discretos, algunos existen como moléculas formadas por dos o más átomos del elemento unidos químicamente. Por ejemplo, la mayoría de las muestras de los elementos hidrógeno, oxígeno y nitrógeno están compuestas por moléculas que contienen dos átomos cada una (llamadas moléculas diatómicas) y, por tanto, tienen las fórmulas moleculares H2, O2 y N2, respectivamente. Otros elementos que suelen encontrarse como moléculas diatómicas son el flúor (F2), el cloro (Cl2), el bromo (Br2) y el yodo (I2). La forma más común del elemento azufre está compuesta por moléculas que constan de ocho átomos de azufre; su fórmula molecular es S8 (Figura 2).
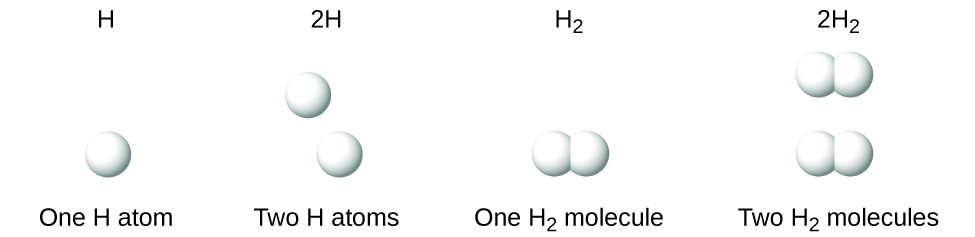
Es importante tener en cuenta que un subíndice a continuación de un símbolo y un número delante de un símbolo no representan lo mismo; por ejemplo, H2 y 2H representan especies claramente diferentes. H2 es una fórmula molecular; representa una molécula diatómica de hidrógeno, formada por dos átomos del elemento unidos químicamente. La expresión 2H, en cambio, indica dos átomos de hidrógeno separados que no están combinados como una unidad. La expresión 2H2 representa dos moléculas de hidrógeno diatómico (Figura 3).
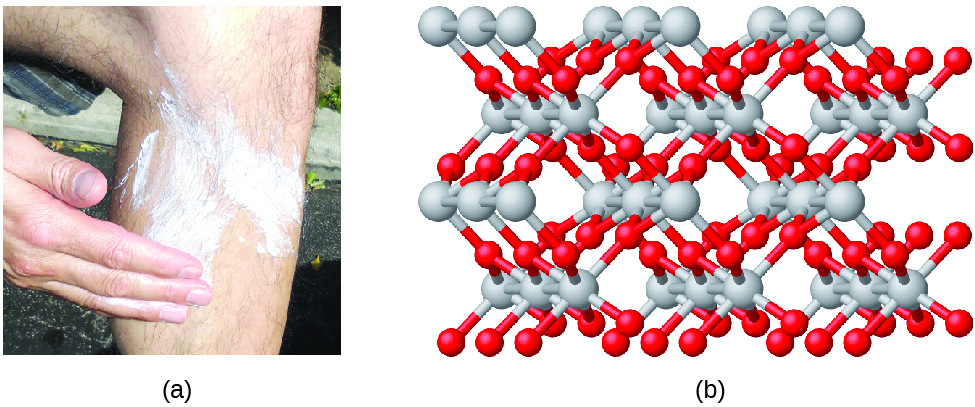
Los compuestos se forman cuando dos o más elementos se combinan químicamente, dando lugar a la formación de enlaces. Por ejemplo, el hidrógeno y el oxígeno pueden reaccionar para formar agua, y el sodio y el cloro pueden reaccionar para formar sal de mesa. A veces describimos la composición de estos compuestos con una fórmula empírica, que indica los tipos de átomos presentes y la relación numérica más simple del número de átomos (o iones) en el compuesto. Por ejemplo, el dióxido de titanio (utilizado como pigmento en la pintura blanca y en el tipo de protector solar grueso y blanco) tiene una fórmula empírica de TiO2. Esto identifica a los elementos titanio (Ti) y oxígeno (O) como constituyentes del dióxido de titanio, e indica la presencia del doble de átomos del elemento oxígeno que de átomos del elemento titanio (Figura 4).
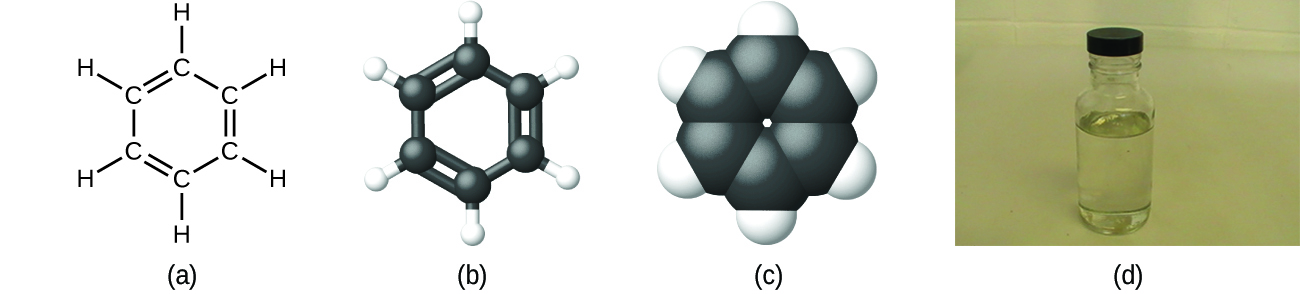
Como se ha comentado anteriormente, podemos describir un compuesto con una fórmula molecular, en la que los subíndices indican el número real de átomos de cada elemento en una molécula del compuesto. En muchos casos, la fórmula molecular de una sustancia se deriva de la determinación experimental tanto de su fórmula empírica como de su masa molecular (la suma de las masas atómicas de todos los átomos que componen la molécula). Por ejemplo, se puede determinar experimentalmente que el benceno contiene dos elementos, carbono (C) e hidrógeno (H), y que por cada átomo de carbono en el benceno hay un átomo de hidrógeno. Por tanto, la fórmula empírica es CH. Una determinación experimental de la masa molecular revela que una molécula de benceno contiene seis átomos de carbono y seis átomos de hidrógeno, por lo que la fórmula molecular del benceno es C6H6 (Figura 5).
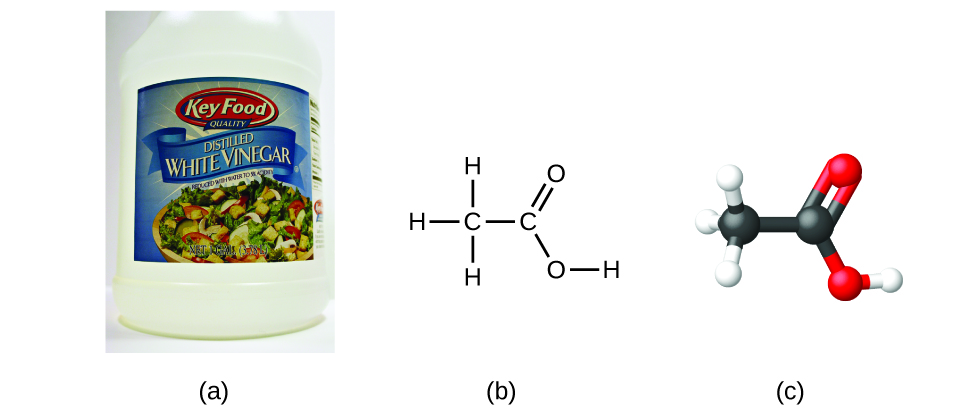
Si conocemos la fórmula de un compuesto, podemos determinar fácilmente la fórmula empírica. (Esto es un poco un ejercicio académico; en la práctica se suele seguir la cronología inversa). Por ejemplo, la fórmula molecular del ácido acético, el componente que da al vinagre su sabor fuerte, es C2H4O2. Esta fórmula indica que una molécula de ácido acético (figura 6) contiene dos átomos de carbono, cuatro de hidrógeno y dos de oxígeno. La proporción de átomos es 2:4:2. Si se divide por el mínimo común denominador (2) se obtiene la proporción más sencilla de átomos, 1:2:1, por lo que la fórmula empírica es CH2O. Ten en cuenta que una fórmula molecular es siempre un múltiplo entero de una fórmula empírica.
Ejemplo 1
Fórmulas empíricas y moleculares
Las moléculas de glucosa (azúcar en sangre) contienen 6 átomos de carbono, 12 átomos de hidrógeno y 6 átomos de oxígeno. ¿Cuáles son las fórmulas molecular y empírica de la glucosa?
Solución
La fórmula molecular es C6H12O6 porque una molécula contiene realmente 6 átomos de C, 12 de H y 6 de O. La proporción más simple de números enteros de átomos de C a H a O en la glucosa es 1:2:1, por lo que la fórmula empírica es CH2O.
Comprueba tu aprendizaje
Una molécula de metaldehído (un pesticida utilizado para caracoles y babosas) contiene 8 átomos de carbono, 16 átomos de hidrógeno y 4 átomos de oxígeno. ¿Cuáles son las fórmulas molecular y empírica del metaldehído?
Respuesta:
Fórmula molecular, C8H16O4; fórmula empírica, C2H4O

Puedes explorar la construcción de moléculas utilizando una simulación online.
Lee Cronin
¿Qué es lo que hacen los químicos? Según Lee Cronin (Figura 7), los químicos fabrican moléculas muy complicadas «troceando» moléculas pequeñas y haciendo «ingeniería inversa» con ellas. Se pregunta si podríamos «crear un conjunto de química universal realmente genial» mediante lo que él denomina «app-ing» de la química. ¿Podríamos «aplicar» la química?
En una charla TED de 2012, Lee describe una posibilidad fascinante: combinar una colección de «tintas» químicas con una impresora 3D capaz de fabricar un aparato de reacción (pequeños tubos de ensayo, vasos de precipitados y similares) para crear un «juego de herramientas universal de química». Este conjunto de herramientas podría utilizarse para crear fármacos a medida para combatir una nueva superbacteria o para «imprimir» medicamentos configurados personalmente según la composición genética, el entorno y la situación de salud. Dice Cronin: «Lo que Apple hizo por la música, me gustaría hacerlo por el descubrimiento y la distribución de medicamentos». Vea su charla completa en la web de TED.

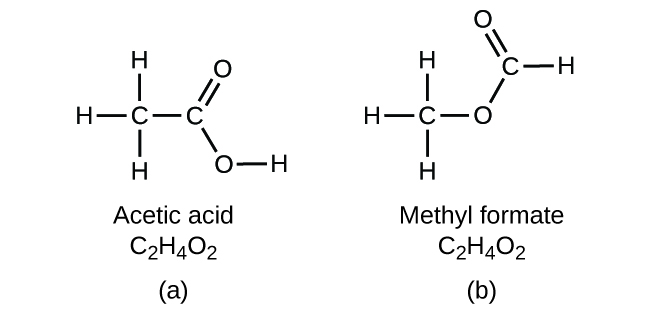
Es importante saber que es posible que los mismos átomos estén dispuestos de diferentes maneras: Los compuestos con la misma fórmula molecular pueden tener diferentes enlaces entre átomos y, por tanto, diferentes estructuras. Por ejemplo, ¿podría haber otro compuesto con la misma fórmula que el ácido acético, C2H4O2? Y si es así, ¿cuál sería la estructura de sus moléculas?
Si predices que podría existir otro compuesto con la fórmula C2H4O2, entonces has demostrado una buena visión química y estás en lo cierto. Dos átomos de C, cuatro átomos de H y dos átomos de O también pueden disponerse para formar un formiato de metilo, que se utiliza en la fabricación, como insecticida y para acabados de secado rápido. Las moléculas de formiato de metilo tienen uno de los átomos de oxígeno entre los dos átomos de carbono, lo que difiere de la disposición de las moléculas de ácido acético. El ácido acético y el formiato de metilo son ejemplos de isómeros, es decir, compuestos con la misma fórmula química pero con estructuras moleculares diferentes (Figura 8). Tenga en cuenta que esta pequeña diferencia en la disposición de los átomos tiene un efecto importante en sus respectivas propiedades químicas. Desde luego, no querrá utilizar una solución de formiato de metilo como sustituto de una solución de ácido acético (vinagre) cuando prepare un aliño para la ensalada.
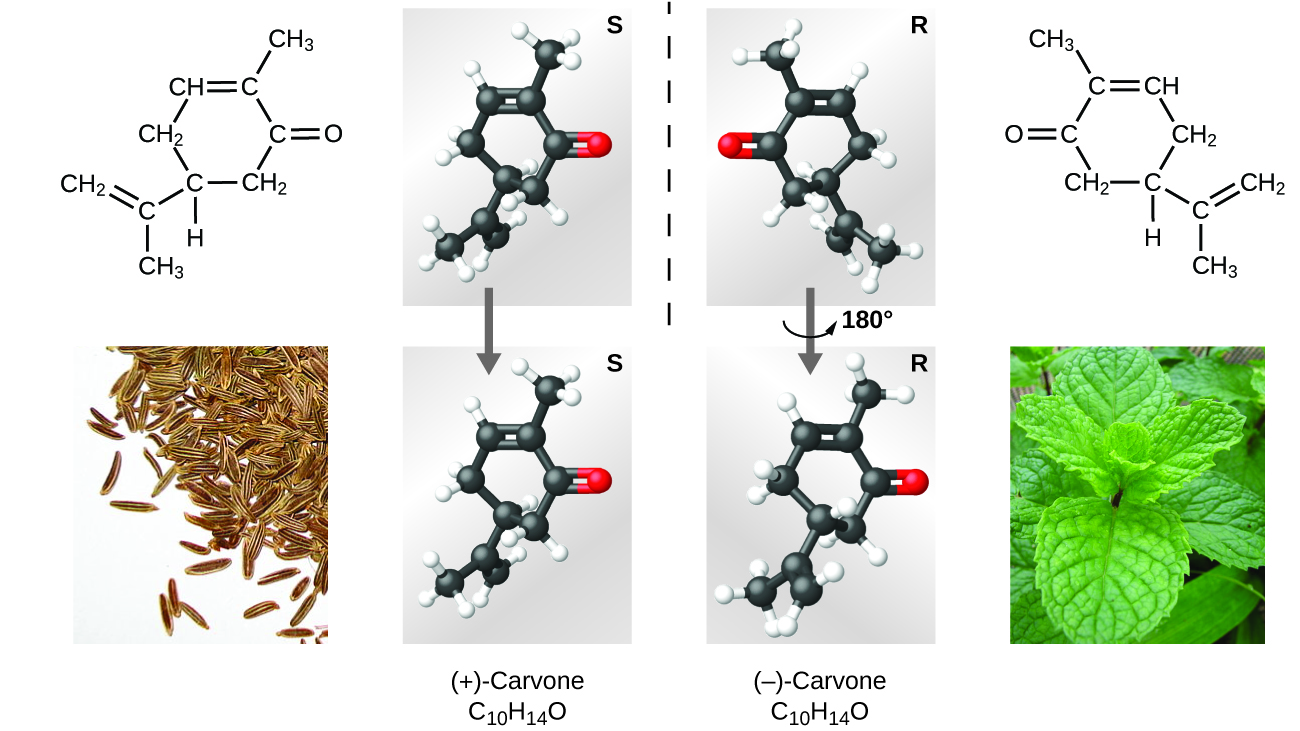
Existen muchos tipos de isómeros (Figura 9). El ácido acético y el formiato de metilo son isómeros estructurales, compuestos en los que las moléculas difieren en la forma en que los átomos están conectados entre sí. También hay varios tipos de isómeros espaciales, en los que las orientaciones relativas de los átomos en el espacio pueden ser diferentes. Por ejemplo, el compuesto carvona (que se encuentra en las semillas de alcaravea, la menta verde y las cáscaras de mandarina) consta de dos isómeros que son imágenes especulares entre sí. La S-(+)-carvona huele a alcaravea, y la R-(-)-carvona huele a menta verde.

Seleccione este enlace para ver una explicación de los isómeros los isómeros espaciales y por qué tienen olores diferentes (seleccione el vídeo titulado «Molécula espejo: Carvone»).
Una fórmula molecular utiliza símbolos químicos y subíndices para indicar el número exacto de los diferentes átomos de una molécula o compuesto. Una fórmula empírica da la proporción más simple de números enteros de átomos en un compuesto. Una fórmula estructural indica la disposición de los átomos en la molécula. Los modelos de bola y palo y de llenado de espacio muestran la disposición geométrica de los átomos en una molécula. Los isómeros son compuestos con la misma fórmula molecular pero con diferentes disposiciones de los átomos.
Ejercicios de fin de capítulo de química
- Explica por qué el símbolo de un átomo del elemento oxígeno y la fórmula de una molécula de oxígeno difieren.
- Explica por qué el símbolo del elemento azufre y la fórmula de una molécula de azufre difieren.
- Escribe las fórmulas moleculares y empíricas de los siguientes compuestos:
(a)
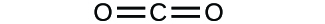
(b)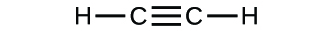
(c)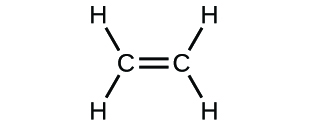
(d)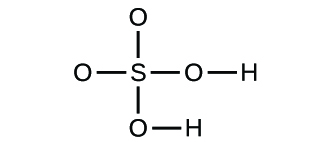
- Escribe las fórmulas moleculares y empíricas de los siguientes compuestos:
(a)
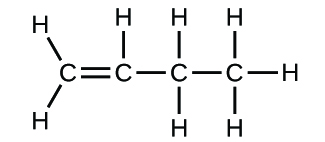
(b)
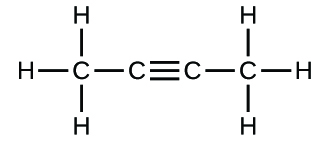
(c)
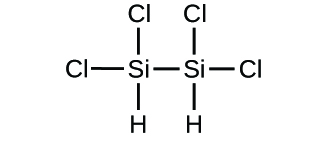
(d)
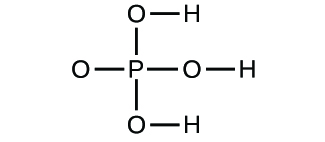
- Determine las fórmulas empíricas de los siguientes compuestos:
(a) cafeína, C8H10N4O2
(b) fructosa, C12H22O11
(c) peróxido de hidrógeno, H2O2
(d) glucosa, C6H12O6
(e) ácido ascórbico (vitamina C), C6H8O6
- Determine las fórmulas empíricas de los siguientes compuestos:
(a) ácido acético, C2H4O2
(b) ácido cítrico, C6H8O7
(c) hidracina, N2H4
(d) nicotina, C10H14N2
(e) butano, C4H10
- Escriba las fórmulas empíricas de los siguientes compuestos:
(a)
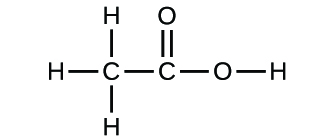
(b)
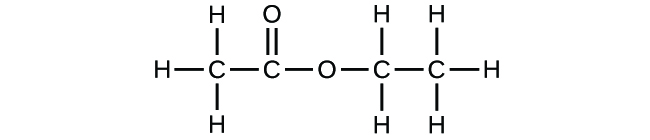
- Abra la simulación Construir una molécula y seleccione la pestaña «Moléculas más grandes». Seleccione un «Kit» de átomos apropiado para construir una molécula con dos átomos de carbono y seis de hidrógeno. Arrastra los átomos al espacio sobre el «Kit» para crear una molécula. Aparecerá un nombre cuando hayas hecho una molécula que exista (aunque no sea la que quieres). Puedes utilizar la herramienta tijera para separar los átomos si quieres cambiar las conexiones. Haz clic en «3D» para ver la molécula, y fíjate en las posibilidades de rellenar el espacio y de hacer bolas.
(a) Dibuja la fórmula estructural de esta molécula y di su nombre.
(b) ¿Puedes ordenar estos átomos de alguna manera para hacer un compuesto diferente?
- Utilice la simulación Construir una molécula para repetir el Ejercicio de fin de capítulo de Química 8, pero construya una molécula con dos carbonos, seis hidrógenos y un oxígeno.
(a) Dibuje la fórmula estructural de esta molécula y diga su nombre.
(b) ¿Puede ordenar estos átomos para hacer una molécula diferente? Si es así, dibuja su fórmula estructural e indica su nombre.
(c) ¿En qué se parecen las moléculas dibujadas en (a) y (b)? ¿En qué se diferencian? Cómo se llaman (el tipo de relación entre estas moléculas, no sus nombres).
- Utiliza la simulación Construye una molécula para repetir el Ejercicio de química de fin de capítulo 8, pero construye una molécula con tres carbonos, siete hidrógenos y un cloro.
(a) Dibuja la fórmula estructural de esta molécula y di su nombre.
(b) ¿Puedes ordenar estos átomos para hacer una molécula diferente? Si es así, dibuja su fórmula estructural e indica su nombre.
(c) ¿En qué se parecen las moléculas dibujadas en (a) y (b)? ¿En qué se diferencian? ¿Cómo se llaman (el tipo de relación entre estas moléculas, no sus nombres)?
Glosario
fórmula empírica fórmula que muestra la composición de un compuesto dada como la proporción más simple de números enteros de átomos isómeros compuestos con la misma fórmula química pero diferentes estructuras fórmula molecular fórmula que indica la composición de una molécula de un compuesto y da el número real de átomos de cada elemento en una molécula del compuesto. isómeros espaciales compuestos en los que las orientaciones relativas de los átomos en el espacio difieren fórmula estructural muestra los átomos de una molécula y cómo están conectados isómero estructural una de dos sustancias que tienen la misma fórmula molecular pero diferentes propiedades físicas y químicas debido a que sus átomos están unidos de forma diferente
Soluciones
Respuestas a los ejercicios de fin de capítulo de Química
1. El símbolo del elemento oxígeno, O, representa tanto al elemento como a un átomo de oxígeno. Una molécula de oxígeno, O2, contiene dos átomos de oxígeno; el subíndice 2 en la fórmula debe utilizarse para distinguir la molécula diatómica de dos átomos de oxígeno simples.
3. (a) CO2 molecular, CO2 empírico; (b) C2H2 molecular, CH empírico; (c) C2H4 molecular, CH2 empírico; (d) H2SO4 molecular, H2SO4 empírico
5. (a) C4H5N2O; (b) C12H22O11; (c) HO; (d) CH2O; (e) C3H4O3
7. (a) CH2O; (b) C2H4O
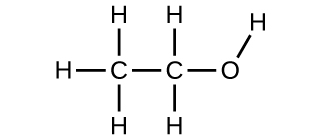
9. (a) etanol
(b) metoximetano, más conocido como éter dimetílico
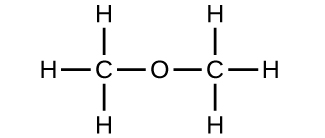
(c) Estas moléculas tienen la misma composición química (tipos y número de átomos) pero diferentes estructuras químicas. Son isómeros estructurales.
- Lee Cronin, «Print Your Own Medicine», charla presentada en TED Global 2012, Edimburgo, Escocia, junio de 2012. ↵