¿Por qué se unen los átomos entre sí?
Los átomos se unen entre sí para poder reducir su energía y hacerse estables. Y cuando los átomos se unen a otros átomos, suelen formar moléculas con propiedades químicas y físicas únicas. Utilicemos el siguiente modelo para explicar cómo se unen los átomos para hacerse estables.
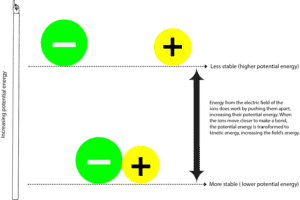
Cuando el átomo con carga negativa (anión) y el átomo con carga positiva (catión) forman un enlace, suelen ser más estables y con menor energía potencial. La energía potencial es la energía debida a las posiciones relativas de estos iones en el campo eléctrico que los rodea. El campo eléctrico es un área en la que se ejerce una fuerza. En cierto modo, un campo eléctrico es similar a un campo magnético. Y se pueden ver estas líneas de fuerza que rodean a un imán cuando se extienden limaduras de hierro a su alrededor.
Para separar el ion negativo del positivo, el campo eléctrico que rodea a los iones debe hacer el trabajo de separar estos iones. Mientras el campo eléctrico hace esto, también transfiere energía a estas partículas, aumentando su energía potencial. Puedes relacionar este proceso con el hecho de tirar de dos imanes que se atraen. En este caso, tú eres el campo de fuerza que suministra la energía para separarlos, y al separarlos, los imanes aumentan su energía potencial. Y como tienen que hacer más trabajo para alejarse el uno del otro, se vuelven inestables. En cuanto los sueltas, los dos imanes se atraen rápidamente entre sí, disminuyendo su energía potencial. Ahora,
¿A dónde fue a parar el resto de la energía potencial?
Esa energía se transfirió de nuevo a ti y a los alrededores en forma de energía cinética. La energía cinética es la energía que tiene un objeto cuando se mueve, y a menudo sentimos esta energía como calor. Así que cada vez que sientes calor, significa que la energía se está moviendo de un lugar más caliente a un lugar más frío. O dicho de otro modo, de una fuente más concentrada a otra menos concentrada. Tenga en cuenta que la energía nunca puede ser transferida al revés – de un lugar más frío a uno más caliente.
Así que como la energía se transfiere desde y hacia el campo o desde y hacia el universo, solemos decir que la energía se conserva. Lo que significa que no podemos crear o destruir energía, sólo podemos convertirla de una forma a otra. Es decir, de energía potencial a cinética y de energía cinética a potencial.
¿Qué utilizan los átomos para unirse a otros átomos?
Los átomos utilizan sus electrones de valencia para unirse a otros átomos. Y para que los átomos se unan, deben hacer al menos una de las siguientes cosas;
- ganar electrones de otros átomos
- perder electrones con otros átomos
- compartir electrones con otros átomos
Y recuerda que los electrones de valencia ocupan el orbital de mayor energía en un átomo. Y puedes visualizar estos electrones cuando escribas la configuración electrónica de un átomo. Si lo haces con los elementos del grupo principal del primer y segundo periodo, te darás cuenta de que el hidrógeno tiene un electrón de valencia, el nitrógeno tiene 5, el oxígeno tiene 6 y el neón tiene 8.
Si dibujamos estos electrones de valencia poniendo punto(s) en la parte superior, derecha, inferior e izquierda de sus símbolos químicos, obtendremos estos sencillos diagramas llamados diagramas de puntos de Lewis, llamados así en honor a Lewis, que fue el primero en utilizarlos para explicar la idea de enlace. Ahora, vamos a seguir hablando del enlace con las siguientes estructuras de Lewis:
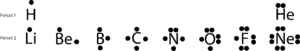
Si te fijas en los elementos del segundo periodo, te darás cuenta de que sólo el Neón (Ne) tiene dos electrones en cada uno de sus cuatro lados. Si sumas todos los electrones de los cuatro lados, descubrirás que hay ocho electrones rodeándolo.
El número ocho está ligado al último dígito del número de grupo al que pertenece el Ne, el grupo 18. Este grupo especial de elementos, llamados gases nobles, tiende a ser estable y poco reactivo en condiciones normales. A excepción del helio, todos tienen ocho electrones de valencia en el grupo.
Debido a su comportamiento químico, Lewis pudo deducir que para que los demás elementos alcancen una configuración estable como la de los gases nobles, deben reaccionar con otros átomos para lograrlo. A partir de esta conclusión, Lewis propuso la regla del octeto. La regla del ocho.
Pero hay excepciones, como se puede deducir, el hidrógeno sólo necesita dos electrones para lograr una configuración estable similar a la del He. A pesar de esta y otras carencias, las estructuras de puntos de Lewis pueden explicar cómo se enlazan los átomos de forma sencilla sin que tengamos que dibujar complejos orbitales atómicos.
¿Qué hace que los átomos se unan a otros átomos?
¡La energía! La energía suele ser la fuerza motriz del enlace. Para que los átomos se unan, deben lograr un delicado equilibrio entre las fuerzas de atracción y repulsión de sus núcleos y electrones. Para saber cómo dos átomos de hidrógeno comparten electrones para crear la molécula de hidrógeno, haz clic aquí.