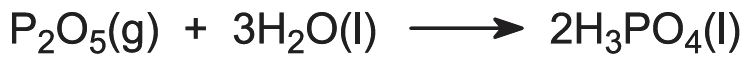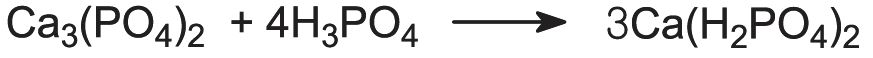Usos del ácido fosfórico
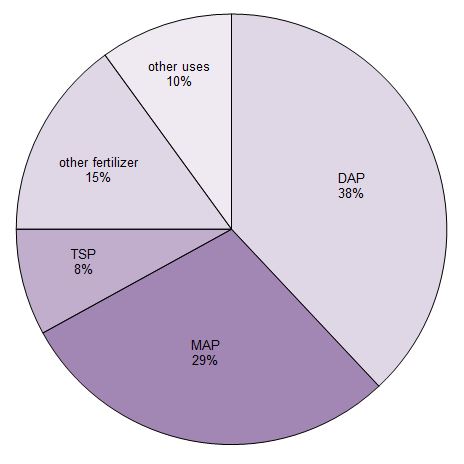
Alrededor del 90% del ácido fosfórico producido se utiliza para fabricar fertilizantes. Se convierte principalmente en tres sales de fosfato que se utilizan como fertilizantes. Son el superfosfato triple (TSP), el hidrogenofosfato de diamonio (DAP) y el dihidrogenofosfato de monoamonio (MAP).
Figura 1 Usos del ácido fosfórico.
Datos de Potash Corporation, 2014
Los fosfatos también se utilizan de otras muchas maneras, como en los refrescos y como suplemento en los piensos que se dan al ganado, a los cerdos y a las aves de corral.
Aunque su uso como reconstituyentes en los detergentes se ha ido eliminando en muchos países, sigue siendo un uso importante del ácido en algunos países.
Producción anual de ácido fosfórico
| Mundial | 43 millones de toneladas1,2,3 |
| China | 17 millones de toneladas4 |
| Sudeste y nordeste deeste de Asia (incluyendo Indonesia y Japón) |
10 millones de toneladas4 |
| Estados Unidos | 8.4 millones de toneladas5 |
1 Potash Corporation, 2014
2 JDCPhosphate, 2014
3 Estimación para 2016
4 Extrapolada a partir de datos, IHS,Markit, 2015
5 2015 Business of Chemistry, American Chemistry Council, 2016
Fabricación de ácido fosfórico
El ácido fosfórico se fabrica mediante dos procesos:
a) el proceso «húmedo»
b) el proceso térmico
El método térmico normalmente produce un producto más concentrado y más puro, pero es intensivo en energía (debido a la fabricación del propio fósforo. El ácido producido por la vía «húmeda» es menos puro pero se utiliza en la fabricación de fertilizantes.
(a) Proceso húmedo
El ácido fosfórico se produce a partir de la fluorapatita, conocida como roca fosfórica, 3Ca3(PO4)2.CaF2, mediante la adición de ácido sulfúrico concentrado (93%) en una serie de reactores bien agitados. El resultado es ácido fosfórico y sulfato de calcio (yeso), además de otras impurezas insolubles. Se añade agua y el yeso se elimina por filtración junto con otros materiales insolubles (por ejemplo, sílice). El fluoruro, como H2SiF6, se elimina en una etapa posterior por evaporación.
Aunque la reacción tiene lugar en etapas en las que interviene el dihidrogenofosfato de calcio, la reacción global puede representarse como:
Sin embargo, hay reacciones secundarias; por ejemplo con el fluoruro de calcio y el carbonato de calcio presentes en la roca:


El ácido fluorosilícico es un importante subproducto de esto y de la fabricación de fluoruro de hidrógeno. Puede neutralizarse con hidróxido de sodio para formar hexafluorosilicato de sodio. El ácido también se utiliza para hacer fluoruro de aluminio, utilizado a su vez en la fabricación de aluminio.
La estructura cristalina del sulfato de calcio formado depende de las condiciones de la reacción. A 340-350 K, el producto principal es el dihidrato, CaSO4.2H2O. A 360-380 K, se produce el hemihidrato, CaSO4.1/2H2O.
El sulfato de calcio se filtra y el ácido se concentra hasta un 56% de P2O5 mediante destilación al vacío.
El producto del ácido del «proceso húmedo» es impuro pero puede utilizarse, sin más purificación, para la fabricación de fertilizantes (véase más adelante). Alternativamente, se puede evaporar aún más hasta llegar a un 70% de P2O5, una solución llamada ácido superfosfórico que se utiliza directamente como fertrilizante líquido.
Para hacer fosfatos industriales, el ácido se purifica mediante extracción con disolventes utilizando, por ejemplo, metil isobutil cetona (MIBK) en la que el ácido es ligeramente soluble y se concentra para dar un contenido de 60% de P2O5. Este ácido puede purificarse aún más utilizando disolventes para extraerlo de los metales pesados y defluorado (por evaporación) para obtener un producto de calidad alimentaria.
(b) Proceso térmico
Las materias primas de este proceso son el fósforo y el aire:
Inicialmente, el fósforo se pulveriza en el horno y se quema en aire a unos 1800-3000 K.
La mayoría de los procesos utilizan aire sin secar y muchos implican la adición de vapor al quemador de fósforo para producir y mantener una película de ácidos polifosfóricos condensados que protegen la torre del quemador de acero inoxidable (refrigerada externamente por agua). Los productos de la torre del quemador pasan directamente a una torre de hidratación donde el óxido de fósforo gaseoso se absorbe en ácido fosfórico reciclado:
Alternativamente, el fósforo puede quemarse en aire seco. El pentóxido de fósforo se condensa como un polvo blanco y se hidrata por separado en ácido fosfórico.
Este método permite recuperar el calor y reutilizarlo.
La quema y la hidratación directa, como se ha descrito anteriormente, crean condiciones altamente corrosivas. El equipo se construye con acero inoxidable o está revestido de ladrillos de carbono. Para reducir la corrosión, las paredes del quemador y de las torres de hidratación se enfrían, pero los productos del reactor salen a una temperatura demasiado baja para la recuperación de calor útil.
El producto ácido tiene una concentración de aproximadamente el 85%.
El ácido tetrafosfórico, uno de una familia de ácidos polifosfóricos que puede producirse selectivamente, se hace bien hirviendo el agua a altas temperaturas en un recipiente de carbono, o añadiendo pentóxido de fósforo sólido al ácido fosfórico casi hirviendo. El primer método suele dar el producto más puro, debido al alto contenido en arsénico del pentóxido de fósforo.
Fosfatos
Las sales del ácido fosfórico, los fosfatos, son los compuestos que se utilizan ampliamente en la agricultura, la industria y en el hogar.
(a) Fosfatos de amonio
El dihidrogenofosfato de monoamonio y el hidrogenofosfato de diamonio son muy utilizados como fertilizantes y se fabrican mezclando las proporciones correctas de ácido fosfórico con amoníaco anhidro en un tambor giratorio.
La elección de qué fosfato amónico utilizar depende de la proporción de nitrógeno y fósforo que necesite el cultivo.
(b) Fosfatos de calcio
Los fosfatos de calcio se utilizan mucho como fertilizantes. El dihidrogenofosfato de calcio, Ca(H2PO4)2, se produce por la reacción de la roca fosfórica con ácido sulfúrico:
Se conoce como superfosfato. Contiene aproximadamente un 20% de P2O5.
Si la roca fosfórica se trata con ácido fosfórico, en lugar de con ácido sulfúrico, se produce una forma más concentrada de dihidrogenofosfato de calcio con un nivel general de P2O5 más alto (50%):
Esto se conoce como superfosfato triple. El mayor nivel de fosfato se consigue porque el producto ya no se diluye con sulfato de calcio.
(c) Fosfatos de sodio
Los fosfatos de sodio se producen por reacción del ácido fosfórico y una solución concentrada de hidróxido de sodio en las proporciones adecuadas (estequiométricas). El producto se cristaliza.
- El dihidrogenofosfato monosódico (MSP, NaH2PO4) se utiliza en formulaciones de limpieza de metales y preparación de superficies, como fuente de fosfato en la fabricación de productos farmacéuticos, y como agente de control del pH en dentífricos, en el recubrimiento de esmalte vítreo (artículos sanitarios) y en la fabricación de fosfatos de almidón. Uno de los mayores usos es como tratamiento de plumbosolvencia en el agua potable. El ácido fosfórico o el MSP pueden utilizarse para producir una fina capa insoluble de fosfato de plomo en las tuberías de plomo para evitar la disolución del plomo por los ácidos del agua.
- El hidrogenofosfato disódico (Na2HPO4) se utiliza como agente ablandador en el queso procesado, en esmaltes y vidriados cerámicos, en el curtido de pieles, en la fabricación de tintes y como inhibidor de la corrosión en el tratamiento del agua.
- El fosfato trisódico (Na3PO4) se utiliza en limpiadores de alta resistencia, por ejemplo para desengrasar el acero. Es un álcali y un secuestrador de los iones de calcio, manteniéndolos en solución y evitando la formación de una espuma.
- El pirofosfato disódico (Na2H2P2O7) se utiliza como agente leudante en el pan/tartas (ayuda a la liberación de dióxido de carbono del bicarbonato de sodio), como supresor del óxido de hierro (efecto de oscurecimiento o pardeamiento) en la fabricación de diversos alimentos y como dispersante en el lodo de perforación de pozos petrolíferos.
- .