Hidratación
Cuando el cloruro de sodio se disuelve en agua, los iones de sodio y cloruro y las moléculas polares de agua se atraen fuertemente entre sí mediante interacciones iónicas-dipolares. Las moléculas de disolvente (agua en este caso) rodean a los iones sacándolos del cristal y formando la solución. A medida que el proceso de disolución avanza, los iones individuales se desprenden de la superficie del sólido convirtiéndose en especies completamente separadas e hidratadas en la solución.
Disolución del NaCl en el agua
Tu navegador no soporta la etiqueta de vídeo
Para que el cloruro de sodio se disuelva en el agua tienen que ocurrir tres procesos:
- Las moléculas de agua deben separarse (deben romperse los enlaces H)
- Las fuerzas de atracción entre los iones de la red de NaCl deben romperse
- Deben formarse interaciones soluto-disolvente (ion-dipolo)
- El cambio de entalpía global en la formación de una solución es la suma de los cambios de energía de cada uno de estos procesos.
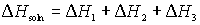

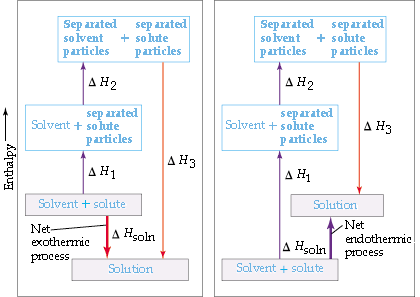
Que el proceso de disolución sea exotérmico o endotérmico depende de las magnitudes relativas de los cambios de energía de los tres pasos. En general, una sustancia será insoluble si la energía que se gasta para separar las partículas de disolvente y soluto es significativamente mayor que la energía que se desprende cuando se establecen las interacciones entre el soluto y el disolvente.
Energía de hidratación
Si se tomaran cationes gaseosos y se pusieran en agua, formarían iones hidratados y liberarían grandes cantidades de energía.Esta energía se llama energía de hidratación del catión. Aunque se trata de un experimento imposible de realizar, las energías de hidratación se han determinado de forma indirecta (verás cómo se hace más adelante en el trimestre).

PROBLEMAS - Utilizando los datos de la Tabla de Energías de Hidratación, explique las tendencias de las entalpías de hidratación frente a los radios iónicos.

Considere elementos de carga y radio similares que tienen diferente electronegatividad.
- Comparar Rb+1 y Tl+1
- Comparar Sr+2 y Pb+2
- Comparar Lu+3 y Tl+3
- Considera los iones del grupo 2A.
- ¿Qué tendencia existe entre el radio iónico y la constante de hidrólisis?

- ¿Qué tendencia existe entre la electronegatividad y la constante de hidrólisis?
- ¿Qué tendencia existe entre el radio iónico y la constante de hidrólisis?
- Considera el Na+1, el Ca+2, y el Pu+3.
- ¿Qué tendencia existe entre la carga iónica y la hidrólisis?
- Ofrece una explicación para las tendencias que observas.
- Determine una relación entre la relación carga/radio y la acidez del catión metálico
- Trace los valores de pKa en función de Z2/r para los cationes que tienen electronegatividades
- Superponga las categorías de acidez en su gráfico y complete la siguiente tabla.
Categoría Rango de pKa Razón Z2/r No ácido 12-15   fácilmente ácido 11.5-14   débilmente ácido 6-11.5 & Moderadamente ácido 1-6 & Fuertemente ácido (-4)-1 &
- Determinar una relación entre la relación carga/radio y la acidez del catión metálico para cationes de electronegatividades >1.5 trazando el pKa frente a donde EN es la electronegatividad y superponiendo las categorías de acidez en su gráfico.
- Compare los dos gráficos. ¿Ves alguna tendencia?
- Ofrecer una explicación para la tendencia observada.
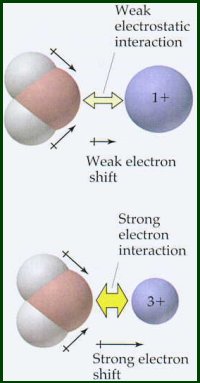
Como se espera de la Ley de Coulomb ![]() , la energía de hidratación de un catión depende de la carga y del radio del catión.
, la energía de hidratación de un catión depende de la carga y del radio del catión.
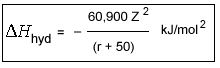 Ecuación de Latimer
Ecuación de Latimer En esta ecuación Z es la carga del catión y r es el radio catiónico (en pm). La constante, 50, equivale aproximadamente al radio del átomo de oxígeno en el agua.
La ecuación de Latimer no incluye los efectos de la electronegatividad. Esta ecuación es válida para cationes con electronegatividades inferiores a 1,5. Compare los datos de energía de hidratación para cationes con electronegatividades 1,5. Los cationes con electronegatividades >1,5 tienen energías de hidratación sustancialmente más altas que los cationes más electropositivos de radio y carga comparables. Estos metales electronegativos tienen cierto grado de enlace covalente en su interacción con el átomo de oxígeno de la molécula de agua, es decir, el par de electrones no compartido del oxígeno se comparte con el átomo de metal.
Hidrólisis
Los iones metálicos en solución acuosa se comportan como ácidos de Lewis. La carga positiva del ion metálico atrae la densidad de electrones del enlace O-H en el agua. Esto aumenta la polaridad del enlace haciendo que sea más fácil de romper. Cuando el enlace O-H se rompe, se libera un protón acuoso produciendo una solución ácida.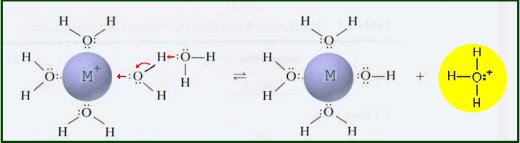
Se puede medir la constante de equilibrio para esta reacción.
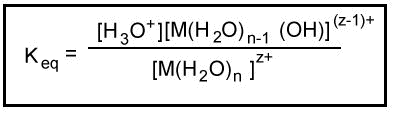
Nota la similitud de la ecuación de la hidrólisis de un catión hidratado con la ecuación de la ionización de un ácido débil en solución acuosa.
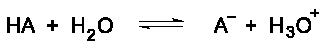

La Keq para la hidrólisis de un catión hidratado es análoga a la Ka para la ionización de un ácido débil. Keq es una constante de ionización del ácido.Generalmente, las constantes de hidrólisis para los cationes se tabulan como -log Ka. Estas constantes de hidrólisis tabuladas son promedios de diferentes mediciones experimentales que a veces difieren en más de una unidad de pKa. Por esta razón, las pequeñas diferencias no se consideran significativas cuando se comparan los valores de estas constantes.

| |
| Utiliza los datos de la Tabla de Constantes de Hidrólisis para Cationes Metálicos para estas preguntas.
|