
Palabras clave:
amorfo,cristal
El vidrio a nivel molecular
Hablamos del vidrio de vez en cuando cuando cuando hablamos de polímeros, especialmente cuando hablamos de materiales compuestos. Las fibras de vidrio se utilizan a menudo para reforzar los polímeros. Pero, ¿qué es esta cosa llamada vidrio? Lo utilizamos mucho con los polímeros, obviamente, pero ¿es el vidrio en sí mismo un polímero?
Antes de abordar esta cuestión, echemos un vistazo a lo que es el vidrio. El vidrio de mayor calidad tiene la fórmula química SiO2. Pero esto es engañoso. Esta fórmula evoca la idea de pequeñas moléculas de dióxido de silicio, análogas a las moléculas de dióxido de carbono. Pero las pequeñas moléculas de dióxido de silicio no existen.

 En cambio, en la naturaleza el SiO2 se encuentra a menudo como un sólido cristalino, con una estructura como la que ves a tu derecha. Cada átomo de silicio está unido a cuatro átomos de oxígeno, de forma tetraédrica, por supuesto; y cada átomo de oxígeno está unido a dos átomos de silicio. Cuando el SiO2 está en esta forma cristalina lo llamamos sílice. Ya has visto la sílice. Cuando se encuentran grandes cristales de ella, la llamamos cuarzo. Cuando tenemos un montón de pequeños cristales de ella, la llamamos arena.
En cambio, en la naturaleza el SiO2 se encuentra a menudo como un sólido cristalino, con una estructura como la que ves a tu derecha. Cada átomo de silicio está unido a cuatro átomos de oxígeno, de forma tetraédrica, por supuesto; y cada átomo de oxígeno está unido a dos átomos de silicio. Cuando el SiO2 está en esta forma cristalina lo llamamos sílice. Ya has visto la sílice. Cuando se encuentran grandes cristales de ella, la llamamos cuarzo. Cuando tenemos un montón de pequeños cristales de ella, la llamamos arena.
Pero esta sílice no es vidrio. Tenemos que hacer algo primero para convertirlo en vidrio. Tenemos que calentarla hasta que se derrita, y luego enfriarla muy rápido. Cuando se funde, los átomos de silicio y oxígeno se salen de su estructura cristalina. Si lo enfriáramos lentamente, los átomos volverían a alinearse en su disposición cristalina a medida que se ralentizan. (Recuerda que el calor es en realidad el movimiento aleatorio de los átomos y las moléculas. Los átomos calientes se mueven mucho, los átomos fríos se mueven muy poco.)
Pero si lo enfriamos lo suficientemente rápido, los átomos de la sílice se detendrán en su camino, por así decirlo. No tendrán tiempo de alinearse y se quedarán en cualquier disposición. Tendrán un aspecto parecido a este:v
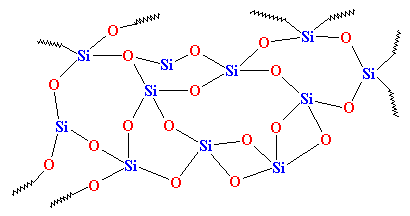
Como puedes ver, no hay orden en la disposición de los átomos. Llamamos a los materiales así amorfos. Este es el vidrio que se utiliza para las lentes de los telescopios y esas cosas. Tiene muy buenas propiedades ópticas, pero es frágil. Para los usos cotidianos, necesitamos algo más resistente. La mayoría de los vidrios se fabrican con arena y, cuando se funde la arena, se suele añadir carbonato de sodio. Esto nos da un vidrio más resistente con una estructura parecida a esta:
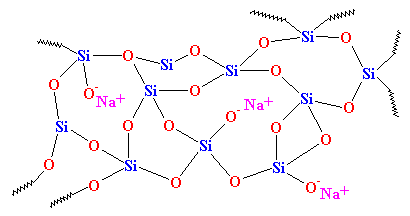
Este es el vidrio que ves todos los días, en frascos y ventanas, y es el que se utiliza en los compuestos. De hecho, antes se llamaba «vidrio de soda» para distinguirlo del cuarzo.
¿Entonces es un polímero o no? Normalmente no se considera como tal. ¿Por qué? Algunos pueden decir que es inorgánico, y los polímeros suelen ser orgánicos. Pero hay muchos polímeros inorgánicos por ahí. Por ejemplo, ¿qué pasa con los polisiloxanos? Estos materiales lineales, y sí, inorgánicos, tienen una estructura muy similar a la del vidrio, y se consideran polímeros. Echa un vistazo a un polisiloxano:
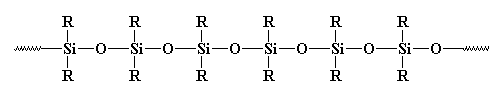
¿Y qué pasa con la reticulación?
En cierto sentido, el vidrio podría considerarse un polisiloxano altamente reticulado. Pero normalmente no pensamos en ello de esa manera. ¿Por qué? Probablemente porque, incluso en un sistema altamente reticulado, se podría trazar una cadena de polímeros y ver dónde están los enlaces cruzados. Pero con el vidrio, sería difícil hacerlo.
Aquí hay una comparación que ilustra este punto: las fibras de carbono y los nanotubos de carbono. Añada un poco de diamante para completar esta familia. «¿Qué familia?», preguntará usted. Sencillamente la del carbono unido a otros carbonos en un conjunto bidimensional o tridimensional, y NO unido a nada más. Carbono puro!
¿Por qué el carbono completamente reticulado no es un polímero?
Ahora recuerda que el carbono realmente quiere estar unido a otros cuatro átomos. Normalmente son cuatro átomos distintos, pero los enlaces múltiples al mismo átomo también cuentan. Ahí es donde entran la mayoría de los monómeros de vinilo: tienen un doble enlace carbono-carbono, lo que significa que cada carbono del vinilo sólo puede estar unido a otros dos átomos además del carbono del otro extremo del doble enlace: cuatro enlaces en total.
Ahora viene la parte interesante. En el grafeno, las fibras de carbono y los nanotubos de carbono, los carbonos SÓLO están unidos a otros átomos de carbono. Sin embargo, en estos compuestos, cada carbono tiene una combinación de enlaces dobles y simples, lo que hace que haya un conjunto de orbitas moleculares altamente deslocalizadas. Esto significa que estos materiales conducen electrones y son eléctricamente conductores. Interesante experimento: poner un montón de fibras de carbono en un microondas y hacer zapping: ¡llamas y humo cuando los electrones que se mueven en el material reaccionan con el oxígeno y se convierten en humo!
El diamante es aún más interesante, ya que es el material más duro conocido. ¿Por qué es tan duro y a la vez tan transparente y capaz de refractar la luz de forma tan bella? Al fin y al cabo, sólo es carbono puro, pero con un truco: ahora cada carbono tiene cuatro enlaces simples con otros cuatro átomos de carbono. Este conjunto perfectamente simétrico de carbonos tiene un conjunto perfecto de enlaces que van en cuatro direcciones diferentes. «No hay nada mejor que esto», se podría decir.
Entonces, ¿se piensa que estas redes totalmente de carbono son polímeros? No, y por la misma razón que el vidrio no lo es. Todo se reduce a la convención y a la historia. Desde que descubrimos cómo era un polímero orgánico, el vidrio y el diamante no encajaban. Un prejuicio, si se quiere, ya que cumplen el requisito de ser un polímero completamente reticulado. Oh, bueno, otras batallas que librar…
 |
Volver al directorio del nivel tres |
 |
Volver al Directorio de la Macrogallería |