¿Qué es el espín del electrón?
El espín del electrón es una propiedad cuántica de los electrones.Es una forma de momento angular.La magnitud de este momento angular es permanente.Al igual que la carga y la masa en reposo, el espín es una propiedad fundamental e invariable del electrón.

Como método de enseñanza, los instructores a veces comparan el espín del electrón con el giro de la tierra sobre su propio eje cada 24 horas.Si el electrón gira en el sentido de las agujas del reloj sobre su eje, se describe como espín hacia arriba; en sentido contrario a las agujas del reloj es espín hacia abajo.Esta es una explicación conveniente, si no es totalmente justificable matemáticamente.
El momento angular de espín asociado con el espín del electrón es independiente del momento angular orbital, que se asocia con el viaje del electrón alrededor del núcleo.
El espín del electrón no se utiliza para definir cáscaras de electrones, subcáscaras u orbitales, a diferencia de los números cuánticos n, l y ml.
Espín del electrón frente al número cuántico de espín del electrón
El espín del electrón y el número cuántico de espín del electrón se tratan a menudo como una misma cosa.Ambos son números cuánticos.En realidad son conceptos diferentes, pero muy relacionados.
– el espín del electrón tiene el símbolo s
– el número cuántico de espín del electrón tiene el símbolo ms.
s
El espín del electrón, s, sólo tiene un valor posible.Ese valor es ½.Al igual que la masa en reposo y la carga del electrón, el espín no varía.
ms
A diferencia de la masa y la carga del electrón, el espín tiene una orientación.La orientación del espín se muestra mediante el número cuántico de espín, ms.
ms puede ser positivo o negativo.
Diferentes formas de expresar ms son escribir:
– + o –
– spin-up o spin-down
–  o
o 
Por ejemplo, en el diagrama de abajo el helio se encuentra en su estado básico de electrones.
Uno de sus electrones es de espín hacia arriba, el otro es de espín hacia abajo. Alternativamente, uno de sus electrones tiene espín positivo, el otro tiene espín negativo.
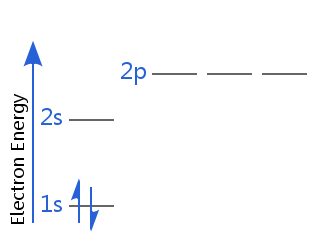
Es habitual decir que cualquier electrón de un átomo está totalmente caracterizado por cuatro números cuánticos:
– n: el número cuántico principal
– l: el número cuántico de momento angular orbital
– ml: el número cuántico magnético
– ms: el número cuántico de espín
No incluimos s, porque su valor no varía. Siempre es la mitad. Así que el valor del número cuántico de espín, ms, se escribe generalmente como ±½.
El descubrimiento del espín del electrón
El espín incorporado o intrínseco del electrón fue detectado por primera vez por Otto Stern y Walther Gerlach en 1922.Sin embargo, la ecuación de onda de Erwin Schrödinger de 1926 no lo tenía en cuenta.
Wolfgang Pauli introdujo con éxito el espín del electrón en la mecánica ondulatoria como un complemento.Ya se utilizaban tres números cuánticos; la introducción del espín por parte de Pauli completó la imagen cuántica del electrón en un átomo de hidrógeno.
En 1928, la famosa ecuación relativista de Paul Dirac para el electrón, la Ecuación de Dirac, produjo el espín del electrón como una consecuencia natural de la física cuántica: el espín ya no era un complemento.
