Objetivos de aprendizaje
- Determinar la susceptibilidad de varias especies bacterianas a diversos antibióticos y agentes sintéticos.
La prueba de Kirby-Bauer para la susceptibilidad a los antibióticos (también llamada prueba de difusión en disco) es un estándar que se ha utilizado durante años. Desarrollada por primera vez en la década de 1950, fue perfeccionada por W. Kirby y A. Bauer, y luego estandarizada por la Organización Mundial de la Salud en 1961. Ha sido sustituido en los laboratorios clínicos por pruebas automatizadas. Sin embargo, el K-B se sigue utilizando en algunos laboratorios, o se utiliza con ciertas bacterias con las que la automatización no funciona bien. Esta prueba se utiliza para determinar la resistencia o la sensibilidad de los aerobios o anaerobios facultativos a productos químicos específicos, que luego pueden ser utilizados por el clínico para el tratamiento de pacientes con infecciones bacterianas. La presencia o ausencia de un área inhibitoria alrededor del disco identifica la sensibilidad bacteriana al fármaco (Figura \(\PageIndex{1}\)).
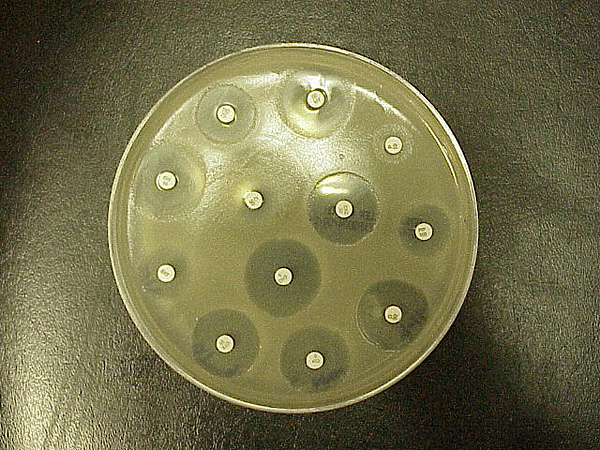
Los fundamentos son fáciles: La bacteria se frota en el agar y los discos de antibiótico se colocan encima. El antibiótico se difunde desde el disco hacia el agar en cantidades decrecientes cuanto más lejos esté del disco. Si el organismo es eliminado o inhibido por la concentración del antibiótico, NO habrá crecimiento en la zona inmediata al disco: Esto se denomina zona de inhibición (figura 9.1). Los tamaños de las zonas se buscan en una tabla estandarizada para dar un resultado de sensible, resistente o intermedio. Muchas tablas tienen una columna correspondiente que también da la CIM (concentración inhibitoria mínima) para ese fármaco. La CIM es actualmente la prueba estándar que se realiza para las pruebas de sensibilidad a los antibióticos porque produce una información más pertinente sobre las dosis mínimas.
El medio Mueller-Hinton que se utiliza para la prueba de Kirby-Bauer es muy alto en proteínas.
MATERIALES NECESARIOS: por tabla
- 2 placas de agar Mueller-Hinton
- Cultivos de 24 horas (probablemente estafilococos, E. coli, Bacillus subtilus, Enterococcus fecalis) hisopos estériles
- antibióticos
- etanol
- fórceps
- Pseudomonas aeruginosa Kirby-Bauer para la demostración
- tabla de pautas para la interpretación de la susceptibilidad a los antibióticos
Los PROCEDIMIENTOS
Cubrimiento del segundo hisopo ►

- Cubra una placa de Mueller-Hinton con SÓLO 2 de las bacterias (en las tablas se ejecutarán diferentes combinaciones de las 4 bacterias). Sumerja un hisopo estéril en el caldo y exprima cualquier exceso de humedad presionando el hisopo contra el lado del tubo.
- Frote la superficie del agar completamente (no quiere dejar ninguna zona de agar sin frotar en absoluto). En las imágenes siguientes, puede ver lo que ocurre cuando la placa no se frota correctamente con una cobertura uniforme de la bacteria en todo el agar.
- Después de frotar completamente la placa, gírela 90 grados y repita el proceso de frotado. (No es necesario volver a humedecer el hisopo.) Pase el hisopo alrededor de la circunferencia de la placa antes de desecharlo en la bolsa de desecho.
- Deje que la superficie se seque durante unos 5 minutos antes de colocar los discos de antibiótico en el agar.
- Los discos de antibiótico:
- Está utilizando dispensadores de antibióticos individuales.
-
 Probablemente tendrá que utilizar un par de fórceps para retirar un disco de antibiótico del dispensador: los fórceps tienen que ser estériles. Coloca las pinzas en alcohol, flamea las pinzas hasta que se incendien, deja que la llama se apague—-pinzas estériles.
Probablemente tendrá que utilizar un par de fórceps para retirar un disco de antibiótico del dispensador: los fórceps tienen que ser estériles. Coloca las pinzas en alcohol, flamea las pinzas hasta que se incendien, deja que la llama se apague—-pinzas estériles. - Toca ligeramente cada disco con tu bucle de inoculación estéril para asegurarte de que está en buen contacto con la superficie del agar. Incubar boca abajo e incubar a 37o C.
INTERPRETACIÓN
-
 Colocar la regla métrica a través de la zona de inhibición, en el diámetro más ancho, y medir desde un borde de la zona hasta el otro borde. Sostener la placa a la luz puede ayudar.
Colocar la regla métrica a través de la zona de inhibición, en el diámetro más ancho, y medir desde un borde de la zona hasta el otro borde. Sostener la placa a la luz puede ayudar. - Utilice medidas milimétricas. El diámetro del disco será en realidad parte de ese número.
- Si no hay ninguna zona, repórtela como 0–aunque el disco en sí sea de unos 7 mm.
- El diámetro de la zona se reporta en milímetros, se busca en la tabla y el resultado se reporta como sensible, resistente o intermedio.
- Registre los resultados de su tabla, así como los de otras tablas, en la tabla.
|
Antibiótico (agente antimicrobiano) |
DISC CODE |
Resistente (< o = mm) |
Intermedio (mm) |
Susceptible (= o > mm) |
|---|---|---|---|---|
| Amoxicilina (otros) | AMC | <13 | 14-17 | mm)» style=»text-Alinear:centro;» class=»lt-bio-3483″>>18 |
| Amoxicilina (estafilococo) | AMC | 19 | mm)» style=»text-Alinear:centro;» class=»lt-bio-3483″>20 | |
| Ampicilina (otros) | AM | 11 | 12-13 | mm)» style=»text-Alinear:centro;» class=»lt-bio-3483″>14 | Ampicilina (estafilococo) | AM | 28 | mm)» style=»text-Alinear:centro;» class=»lt-bio-3483″>29 | Carbenicilina (otros) | CB | 17 | 18- | 17 | mm)» style=»text-align:centro;» class=»lt-bio-3483″>23 |
| Carbenicilina (Pseudomonas) | CB | 13 | 14-16 | mm)» style=»text-align:centro;» class=»lt-bio-3483″>17 | Cefoxitin | FOX | 14 | 15-.17 | mm)» style=»text-align:centro;» class=»lt-bio-3483″>18 |
| Cefalotina | CF | 14 | 15-.17 | mm)» style=»text-align:centro;» class=»lt-bio-3483″>18 |
| Cloranfenicol | C | 12 | 13-…17 | mm)» style=»text-align:centro;»class=»lt-bio-3483″>18 |
| Ciprofloxacina | CIP-5 | 15 | 16-20 | mm)» style=»text-align:centro;»class=»lt-bio-3483″>21 |
| Clindamicina | CC-2 | 14 | 15-20 | mm)» style=»text-align:centro;» class=»lt-bio-3483″>21 |
| Enoxacina (Fluoroquinolona, 2º gen.) | ENX-10 | 14 | 15-17 | mm)» style=»text-align:centro;» class=»lt-bio-3483″>18 |
| Ertromicina | E | 13 | 14-.22 | mm)» style=»text-align:centro;» class=»lt-bio-3483″>23 |
| Gentamicina | GM | 12 | 13-.14 | mm)» style=»text-align:centro;»class=»lt-bio-3483″>15 |
| Kanamicina | K-30 | 13 | 14-17 | mm)» style=»text-align:centro;» class=»lt-bio-3483″>18 |
| Meticilina (estafilococo) | M(oDP) | 9 | 10-13 | mm)» style=»text-align:centro;» class=»lt-bio-3483″>14 |
| Oxacilina (estafilococo) | OX | 10 | 11-12 | mm)» style=»text-align:centro;» class=»lt-bio-3483″>13 |
| Penicilina G (Enterococo) | P | 14 | mm)» style=»text-align:centro;» class=»lt-bio-3483″>15 | Penicilina G (estafilococo) | P | 28 | mm)» style=»text-align:centro;»class=»lt-bio-3483″>29 |
| Estreptomicina | S-10 | 14 | 15-20 | mm)» style=»text-align:centro;»class=»lt-bio-3483″>21 |
| Sulfametoxazol-trimetoprim | SXT | 10 | 11-15 | mm)» style=»text-align:centro;»class=»lt-bio-3483″>16 |
| Tetraciclina | Te-…30 | 14 | 15-18 | mm)» style=»text-align:centro;»class=»lt-bio-3483″>19 |
| Tobramicina | NN-.10 | 12 | 13-14 | mm)» style=»text-align:centro;»class=»lt-bio-3483″>15 |
| Vancomicina | Va-30 | 9 | 10-11 | mm)» style=»text-align:center;»class=»lt-bio-3483″>12 |
Tabla de resultados
Registra los resultados de las 5 bacterias con todos los antibióticos.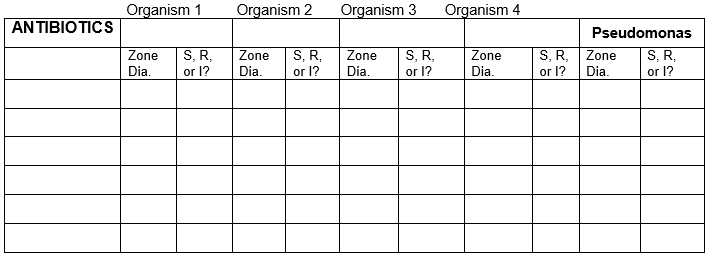
Diámetro de la zona en unidades milimétricas. Utilice la tabla para sensible, resistente o intermedio
Preguntas
- Cuanto mayor sea el tamaño de la zona, más ____________ es la bacteria a ese antibiótico.
- ¿Qué unidades de medida se utilizan para medir los tamaños de las zonas?
- ¿Cómo se compara la sensibilidad de los estafilococos con la de las Pseudomonas?
Contribuidores
-
Jackie Reynolds, Profesora de Biología (Richland College)
La sensibilidad de los estafilococos a los antibióticos es mayor.