Enlaces covalentes simples
El enlace covalente más simple se forma entre dos átomos de hidrógeno. Cada átomo de hidrógeno tiene un solo electrón, y cada uno necesita dos electrones para una capa exterior completa. La molécula de hidrógeno, \ce{H_2}, está formada por dos átomos de hidrógeno que comparten sus dos electrones de valencia. El hidrógeno también puede formar enlaces covalentes con otros átomos. Por ejemplo, el hidrógeno y el cloro necesitan un electrón más cada uno para alcanzar una configuración de gas noble. Al compartir los electrones de valencia (cada átomo dona uno), se forma la molécula estable \ce{HCl}\N.
Utilizaremos una representación simplificada de los enlaces covalentes conocida como estructuras de Lewis. Estos dibujos también se conocen con otros nombres, como estructuras de puntos de Lewis o estructuras de puntos de electrones. Cada punto de la estructura representa un electrón de valencia en el compuesto. Por ejemplo, \ce{H_2} podría dibujarse como \ce{H} : \ce{H}}. Cada punto representa un electrón de valencia, y el hecho de que estén colocados entre los dos átomos significa que están siendo compartidos bas un enlace covalente. Para las moléculas más grandes, puede resultar engorroso dibujar todos los electrones de valencia, por lo que un par de electrones de enlace también se puede dibujar como una línea recta. Así, \ce{H_2} puede representarse también como \ce{H-H}.
Si quisiéramos mostrar la estructura de Lewis de \(\ce{HCl}\), dibujaríamos lo siguiente:

Podemos ver que el enlace covalente consta de dos electrones entre el \ce{H}\ y el \ce{Cl}\). El \(\ce{H}\Ntiene una capa exterior completa de dos electrones y el cloro tiene una capa exterior completa de ocho electrones. Los enlaces covalentes con otros halógenos se pueden escribir de la misma manera.
Se pueden escribir tipos similares de estructuras de Lewis para otras moléculas que forman enlaces covalentes. Muchos compuestos que contienen \ce{O}, \ce{N}, \ce{C}, \ce{S} y \ce{P} se mantienen unidos por enlaces covalentes. El número de enlaces covalentes que formará un átomo puede predecirse generalmente por el número de electrones que el átomo necesita para llenar su capa de valencia. Por ejemplo, el oxígeno tiene 6 electrones en su capa exterior y necesita dos más para llenar esta capa, por lo que sólo formará dos enlaces covalentes con otros átomos. Si miramos la molécula de agua \\N(\ce{H_2O} \\N a la derecha)\N- (véase la figura de abajo), vemos que el oxígeno tiene 6 electrones en su caparazón exterior y necesita dos más para llenar esta caparazón. (véase la figura siguiente), vemos que el átomo de oxígeno realiza dos enlaces totales (uno con cada átomo de hidrógeno).
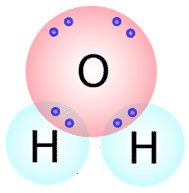
Como puedes ver, hay dos pares de electrones que no participan en el enlace covalente. Estos pares de electrones no enlazados se conocen como pares solitarios y contribuyen a la forma general de la molécula. Del mismo modo, el nitrógeno necesita tres electrones para completar su capa de valencia, por lo que tiende a hacer tres enlaces covalentes, con un par solitario de electrones no enlazantes sobrantes.
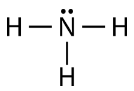
De nuevo, cada una de las líneas representa un par de electrones enlazantes (un solo enlace), y el par solitario del nitrógeno se dibuja como dos puntos.