- Describir la relación entre la concentración de solutos y las propiedades físicas de una solución.
- Comprender que el número total de partículas de soluto no volátil determina la disminución de la presión de vapor, el aumento del punto de ebullición y la disminución del punto de congelación de una solución frente al disolvente puro.
La ósmosis puede demostrarse utilizando un tubo en U como el que se muestra en la Figura \(\PageIndex{1}), que contiene agua pura en el brazo izquierdo y una solución acuosa diluida de glucosa en el brazo derecho. Se produce un flujo neto de agua a través de la membrana hasta que los niveles en los brazos dejan de cambiar, lo que indica que se ha alcanzado el equilibrio. La presión osmótica (\(\Pi\)) de la solución de glucosa es la diferencia de presión entre los dos lados, en este caso las alturas de las dos columnas. Aunque la membrana semipermeable permite que las moléculas de agua fluyan en cualquier dirección, la tasa de flujo no es la misma en ambas direcciones porque la concentración de agua no es la misma en los dos brazos. El flujo neto de agua a través de la membrana se puede evitar aplicando una presión al brazo derecho que sea igual a la presión osmótica de la solución de glucosa.
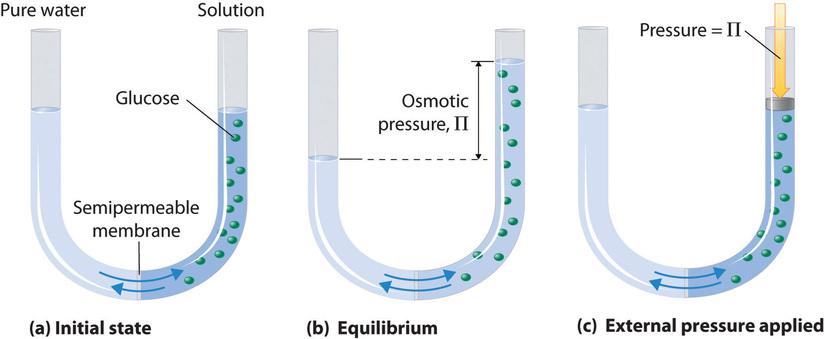
La presión osmótica de una solución depende de la concentración de partículas de soluto disueltas. La presión osmótica obedece a una ley que se asemeja a la ecuación de los gases ideales:
donde
- (M\) es el número de moles de soluto por unidad de volumen de solución (es decir, la molaridad de la solución),
- (R\) es la constante de los gases ideales, y
- (T\) es la temperatura absoluta.
- Calcular la molaridad de la disolución \(NaCl\) utilizando la masa fórmula del soluto y la densidad de la disolución. A continuación, calcule la concentración total de partículas disueltas.
- Utilice la ecuación \ref{eq1} para calcular la presión osmótica de la solución.
- Reste la presión osmótica normal de las células de la presión osmótica de la solución salina para obtener la presión adicional necesaria para equilibrar las dos. Utilice la ecuación \ref{eq1} para calcular la molaridad de glicerol necesaria para crear esta presión osmótica.
Como se muestra en el Ejemplo \(\PageIndex{1}}), las presiones osmóticas tienden a ser bastante altas, incluso para soluciones bastante diluidas.
Ejemplo \(\PageIndex{1}}: Células de levadura
Cuando se colocan en una solución salina concentrada, ciertas levaduras son capaces de producir altas concentraciones internas de glicerol para contrarrestar la presión osmótica del medio circundante. Suponga que las células de levadura se colocan en una solución acuosa que contiene un 4,0% de \(NaCl\) en masa; la densidad de la solución es de 1,02 g/mL a 25°C.
Calcule la presión osmótica de una solución acuosa de \(NaCl\) al 4,0% a 25°C.
Si la presión osmótica normal dentro de una célula de levadura es de 7,3 atm, lo que corresponde a una concentración total de partículas disueltas de 0,30 M, ¿qué concentración de glicerol deben sintetizar las células para equilibrar exactamente la presión osmótica externa a 25°C?
Dados: concentración, densidad y temperatura de la solución \(NaCl\); presión osmótica interna de la célula
Se pide: presión osmótica de la solución \(NaCl\) y concentración de glicerol necesaria
Estrategia:
Solución:
La solución contiene 4,0 g de \(NaCl\) por 100 g de solución. Utilizando la masa de fórmula de \(NaCl\) (58,44 g/mol) y la densidad de la disolución (1,02 g/mL), podemos calcular la molaridad:
&=left(\dfrac{4,0 \}; \cancel{g} \;NaCl}{58.44; \Ncancel{g}/m\Nde NaCl}\N-derecha)\N-izquierda(\N- 100; \Ncancel{g};solución}\N-derecha)\N-izquierda(\N- 1,02; \Ncancel{g};solución}\N- 1.00; |cancelar{mL}{solución}{derecha)|left(\dfrac{1000\}; \cancelar{mL}{1}{solución}{derecha) |nonumber \&
= 0,70\ M; NaCl |end{align} \nonumber]
Debido a que 1 mol de \(NaCl\) produce 2 mol de partículas en solución, la concentración total de partículas disueltas en la solución es (2)(0.70 M) = 1,4 M.
B Ahora podemos utilizar la ecuación \ref{eq1} para calcular la presión osmótica de la solución:
&=(1.4 \;mol/L)\Ndejando de lado (298\; K) \N – &= 34 \;atm \N-end{align*}]
C Si las células de levadura van a equilibrar exactamente la presión osmótica externa, deben producir suficiente glicerol para dar una presión interna adicional de (34 atm – 7,3 atm) = 27 atm. El glicerol es un no electrolito, por lo que podemos resolver la ecuación \ref{eq1} para la molaridad correspondiente a esta presión osmótica:
&= \dfrac{27}; \cancel{atm}{(298 \;\cancel{K})} &= 1,1 \;M \;glicerol \end{align*}]
Al resolver este problema, también podríamos haber reconocido que la única manera de que las presiones osmóticas sean iguales dentro de las células y en la solución es si las concentraciones de las partículas disueltas son las mismas. Se nos da que la concentración normal de partículas disueltas en las células es de 0,3 M, y hemos calculado que la solución \(NaCl\) es efectivamente 1,4 M en partículas disueltas. Por lo tanto, las células de levadura deben sintetizar suficiente glicerol para aumentar la concentración interna de partículas disueltas de 0,3 M a 1,4 M, es decir, una concentración adicional de 1,1 M de glicerol.
Ejercicio \(\PageIndex{1})
Suponga que los fluidos en el interior de una salchicha son aproximadamente 0,80 M en partículas disueltas debido a la sal y al nitrito de sodio utilizados para su preparación. Calcule la presión osmótica en el interior de la salchicha a 100 °C para saber por qué los cocineros experimentados perforan la piel semipermeable de las salchichas antes de hervirlas.
Respuesta: 24 atm
Debido a la gran magnitud de las presiones osmóticas, la ósmosis es extraordinariamente importante en bioquímica, biología y medicina. Prácticamente todas las barreras que separan un organismo o una célula de su entorno actúan como una membrana semipermeable, permitiendo el flujo de agua pero no de solutos. Lo mismo ocurre con los compartimentos del interior de un organismo o célula. Algunas barreras especializadas, como las de los riñones, son ligeramente más permeables y utilizan un proceso relacionado llamado diálisis, que permite el paso tanto del agua como de las moléculas pequeñas, pero no de las grandes, como las proteínas.
El mismo principio se ha utilizado durante mucho tiempo para conservar las frutas y sus vitaminas esenciales durante el largo invierno. En las mermeladas y jaleas se utilizan altas concentraciones de azúcar no sólo por su dulzor, sino porque aumentan mucho la presión osmótica. Así, las bacterias que no se eliminan en el proceso de cocción se deshidratan, lo que impide que se multipliquen en un medio que, de otro modo, sería rico para el crecimiento bacteriano. Un proceso similar en el que se utiliza la sal impide que las bacterias crezcan en el jamón, el tocino, el cerdo salado, el bacalao salado y otras conservas. El efecto de la presión osmótica se ilustra de forma dramática en la figura \(\PageIndex{2}), que muestra lo que ocurre cuando los glóbulos rojos se colocan en una solución cuya presión osmótica es mucho más baja o mucho más alta que la presión interna de las células.

Además de la acción capilar, los árboles utilizan la presión osmótica para transportar agua y otros nutrientes desde las raíces hasta las ramas superiores. La evaporación del agua de las hojas provoca un aumento local de la concentración de sal, lo que genera una presión osmótica que arrastra el agua por el tronco del árbol hasta las hojas.
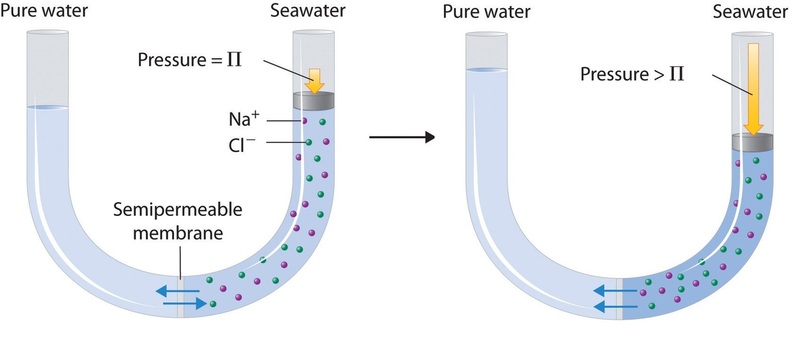
Por último, se puede utilizar un proceso llamado ósmosis inversa para producir agua pura a partir del agua de mar. Como se muestra de forma esquemática en la Figura \(\PageIndex{3}), la aplicación de alta presión al agua de mar obliga a las moléculas de agua a fluir a través de una membrana semipermeable que separa el agua pura de la solución, dejando la sal disuelta. Las plantas de desalinización a gran escala que pueden producir cientos de miles de galones de agua dulce al día son comunes en las tierras desérticas de Oriente Medio, donde suministran una gran proporción del agua dulce que necesita la población. En el sur de California se están utilizando instalaciones similares para suministrar agua dulce. Pequeñas unidades de ósmosis inversa operadas a mano pueden producir aproximadamente 5 L de agua dulce por hora, suficiente para mantener a 25 personas con vida, y son ahora un equipo estándar en los botes salvavidas de la Marina de los Estados Unidos.
Resumen
Cuando una solución y un disolvente puro están separados por una membrana semipermeable, una barrera que permite el paso de moléculas de disolvente pero no de soluto, el flujo de disolvente en direcciones opuestas es desigual y produce una presión osmótica, que es la diferencia de presión entre los dos lados de la membrana. La ósmosis es el flujo neto de disolvente a través de dicha membrana debido a las diferentes concentraciones de soluto. La diálisis utiliza una membrana semipermeable con poros que sólo permiten el paso de pequeñas moléculas de soluto y moléculas de disolvente.