Wat is Electron Spin?
Electron spin is een kwantumeigenschap van elektronen.Het is een vorm van impulsmoment.De grootte van dit impulsmoment is permanent.Net als lading en rustmassa is spin een fundamentele, onveranderlijke eigenschap van het elektron.

Als leermethode vergelijken docenten het draaien van een elektron soms met het draaien van de aarde om haar eigen as elke 24 uur.Als het elektron met de wijzers van de klok mee om zijn as draait, wordt dat beschreven als spin-up; tegen de wijzers van de klok in is dat spin-down.
Het impulsmoment van de spin van het elektron is onafhankelijk van het impulsmoment van de baan, dat samenhangt met de reis van het elektron om de kern.
Elektronspin wordt niet gebruikt om elektronenschillen, subschillen of orbitalen te definiëren, in tegenstelling tot de kwantumgetallen n, l, en ml.
Elektronenspin vs het kwantumgetal elektronenspin
Elektronenspin en het kwantumgetal elektronenspin worden vaak als een en hetzelfde behandeld.Beide zijn kwantumgetallen.Het zijn in feite verschillende, maar zeer nauw verwante begrippen.
– elektronspin heeft symbool s
– het elektronspin-kwantumgetal heeft symbool ms.
s
Elektronspin, s, heeft maar één mogelijke waarde.Die waarde is ½.Net als de rustmassa en de lading van het elektron, varieert spin niet.
ms
In tegenstelling tot de massa en de lading van het elektron heeft spin een oriëntatie.De oriëntatie van de spin wordt weergegeven door het spinquantumgetal, ms.
ms kan positief of negatief zijn.
Verschillende manieren om ms uit te drukken zijn te schrijven:
– + of –
– spin-up of spin-down
–  of
of 
In het onderstaande diagram bevindt helium zich bijvoorbeeld in de grondtoestand van het elektron.
Een van de elektronen is spin-up, de andere spin-down. Of andersom: een van de elektronen heeft positieve spin, het andere negatieve spin.
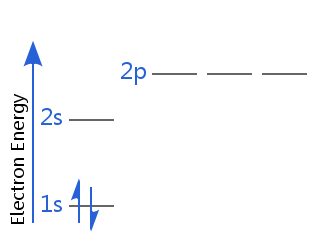
Het is gebruikelijk om te zeggen dat elk elektron in een atoom volledig wordt gekarakteriseerd door vier quantumgetallen:
– n: het hoofdkwantumgetal
– l: het baanhoekmomentkwantumgetal
– ml: het magnetisch kwantumgetal
– ms: het spin-kwantumgetal
We nemen s niet op, omdat de waarde ervan niet varieert. Het is altijd de helft. De waarde van het spin-kwantumgetal, ms, wordt dus meestal geschreven als ±½.
De ontdekking van elektronenspin
De ingebouwde of intrinsieke spin van het elektron werd voor het eerst ontdekt door Otto Stern en Walther Gerlach in 1922.De golfvergelijking van Erwin Schrödinger uit 1926 hield er echter geen rekening mee.
Wolfgang Pauli introduceerde met succes elektronenspin in de golfmechanica als een add-on.Drie kwantumgetallen waren al in gebruik; Pauli’s introductie van spin completeerde het kwantumbeeld van het elektron in een waterstofatoom.
In 1928 produceerde Paul Dirac’s beroemde relativistische vergelijking voor het elektron, de Dirac-vergelijking, elektronspin als een natuurlijk gevolg van de kwantumfysica: spin was niet langer een add-on.
