Nutzen Sie unseren NMR-Service, der 1H NMR und viele andere NMR-Techniken bietet.
Es gibt drei Isotope von Wasserstoff, die in der NMR-Spektroskopie verwendet werden: 1Wasserstoff, 2Deuterium und 3Tritium. Jedes Isotop resoniert auf einer anderen Frequenz, z. B. wenn 1H bei 400 MHz resoniert, dann resoniert 2H bei 61,402 MHz. Es wird jeweils nur ein Isotop beobachtet, da das Spektrometer nur über einen sehr begrenzten Frequenzbereich sendet und empfängt. Die chemischen Verschiebungsbereiche für alle drei Kerne sind praktisch identisch und können für eine erste Analyse verwendet werden, aber dort endet die Ähnlichkeit. 3Tritium wird üblicherweise nicht mit NMR gemessen, da es radioaktiv ist.
Jeder Signaltyp hat einen charakteristischen chemischen Verschiebungsbereich (Abb. 1), der für eine erste Zuordnung verwendet werden kann.
Abbildung 1. Chemische Verschiebungsbereiche von Protonen entsprechend ihrer chemischen Umgebung
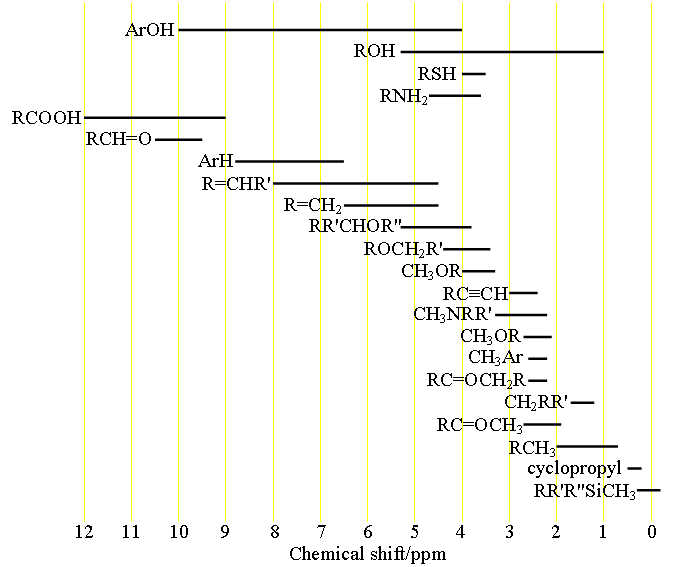
Wählen Sie die Struktur, die den betreffenden Wasserstoff am ehesten repräsentiert. R = Alkyl oder H, Ar = Aryl.
1Wasserstoff (Protonen)-NMR
Das 1D 1H (Protonen)-NMR-Experiment ist das häufigste NMR-Experiment. Das Proton (1H-Wasserstoff-Kern) ist der empfindlichste Kern (abgesehen von Tritium) und liefert in der Regel scharfe Signale. Obwohl sein chemischer Verschiebungsbereich eng ist, machen seine scharfen Signale die Protonen-NMR sehr nützlich. Unser NMR-Service bietet Protonen-NMR zusammen mit vielen anderen NMR-Techniken an.
Eine typische Analyse eines 1H-NMR-Spektrums kann wie folgt ablaufen:
Die Anzahl der Protonen jedes Typs im Spektrum einer reinen Probe kann direkt aus den Integralen der einzelnen Multipletts ermittelt werden. Dies gilt nur, wenn die Multipletts gut getrennt sind und nicht die Lösungsmittel- oder Restwassersignale überlappen und vorausgesetzt, dass das Molekül keinen langsamen Konformationsaustausch durchläuft. Ein Routine-NMR-Spektrum liefert Integrale mit einer Genauigkeit von +/-10%. Genauigkeiten von +/-1% können erreicht werden, indem die Relaxationsverzögerung auf das Fünffache der longitudinalen Relaxationszeit (T1) der interessierenden Signale erhöht wird. Bei überlappenden Multipletts kann das Gesamtintegral des Spektralbereichs verwendet werden.
Aus der Tabelle der chemischen Verschiebungen der Protonen erhält man Informationen über jede Art von Protonen und kann eine vorläufige Zuordnung vornehmen.
Betrachten wir Ethanol als Beispiel (Abb. 2). Anhand der chemischen Verschiebungen liegt der Peak bei 1,2 ppm im erwarteten Bereich für CH3 (Methyl) und die Peaks bei 3,7 und 3,9 ppm sind kompatibel mit CH2 (Methylen). Die chemische Verschiebung von OH ist sehr abhängig vom Lösungsmittel und anderen experimentellen Bedingungen und kann daher nicht allein durch die chemische Verschiebung zugeordnet werden.
Bei der Integration erwarten wir, dass CH3 ein Integral von drei, CH2 ein Integral von zwei und OH ein Integral von eins hat. Dies ist der Fall und somit ist die Zuordnung vollständig.
Abb. 2. 1H-NMR-Spektrum von Ethanol in CDCl3
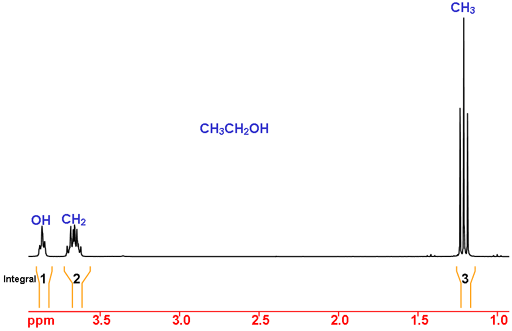
Für andere Moleküle ist dies nicht ausreichend und die Multiplettstruktur wird benötigt, um die Zuordnung zu vervollständigen. Die Multipletts (Abb. 3) entstehen durch Spin-Spin-Kopplungen, die durch chemische Bindungen übertragen werden und Informationen über die unmittelbare molekulare Umgebung liefern. Im Fall von CH3 und OH werden sie durch die beiden benachbarten Protonen des CH2 aufgespalten und ergeben ein Triplettmuster, das AX2 genannt wird. (Klicken Sie hier, um eine Liste häufiger homonuklearer Spaltmuster und eine Beschreibung der heteronuklearen Kopplung zu sehen). Das CH2 wird durch das einzelne OH-Proton und die drei CH3-Protonen gespalten, um das AX3Y-Muster zu bilden. (Weitere Beispiele für die spektrale Zuordnung, 2D-Zuordnung von 12,14-Ditbutylbenzochrysen und 2D-Zuordnung von Cholesterylacetat finden Sie hier)
Abb. 3. Multiplett-Strukturen aus dem 1H-NMR-Spektrum von Ethanol in CDCl3
Nachdem die Multiplizität bestimmt wurde, kann man die Kopplungskonstanten messen. Diese werden in Hz (nicht ppm) gemessen, da sie feldunabhängig sind. Wenn man feststellt, dass zwei (und nur zwei) Multipletts die gleiche Kopplungskonstante aufweisen, weiß man, dass sie von nahegelegenen Protonen stammen. Die Kopplungskonstante gibt einen Hinweis auf den Abstand zwischen den Protonen. Im Allgemeinen bedeuten 10 bis 18 Hz zwei- oder dreibindige trans zu einer C=C-Doppelbindung. Kopplungskonstanten zwischen 1 und 10 Hz deuten auf Dreierbindungen oder mehr Bindungen hin, wenn sie delokalisiert sind. Weniger als 1 Hz bedeutet normalerweise vier oder mehr Bindungen.
Zusätzlich zu den homonuklearen Kopplungen können die Multipletts durch andere Kerne wie 19Fluor oder 31Phosphor aufgespalten werden. (Wenn solche heteronuklearen Kopplungen unerwünscht sind, können sie entkoppelt werden. Die beste Pulsfolge in einem solchen Fall ist die für die inverse gated Entkopplung.)
Eigenschaften von 1H
(Hier klicken zur Erklärung)
| Eigenschaft | Wert |
|---|---|
| Spin | ½ |
| Natürliche Häufigkeit | 99.9845% |
| Chemischer Verschiebungsbereich | 13 ppm, von -1 bis 12 |
| Frequenzverhältnis (Ξ) | 100.000000% |
| Referenzverbindung | TMS < 1% in CDCl3 = 0 ppm |
| Linienstärke der Referenz | 0.08 Hz |
| T1 der Referenz | 14 s |
| Rezeptivität rel. zu 1H bei natürlicher Häufigkeit | 1.000 |
| Empfindlichkeit rel. zu 1H bei Anreicherung | 1,000 |
| Empfindlichkeit rel. zu 13C bei natürlicher Häufigkeit | 5870 |
| Rezeptivität rel. zu 13C bei Anreicherung | 5871 |
2Deuterium NMR
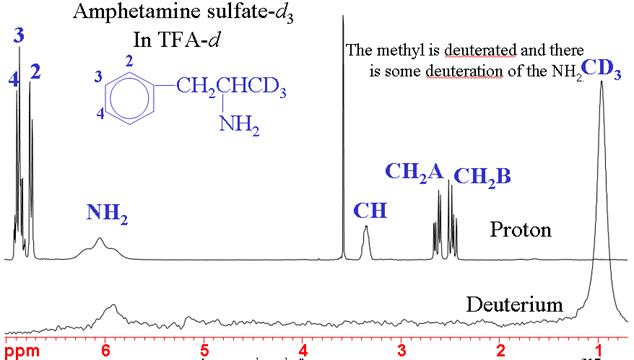
2Deuterium (schwerer Wasserstoff) NMR wird normalerweise für die Feldfrequenzsperre verwendet. In natürlicher Häufigkeit hat es eine sehr geringe Empfindlichkeit, aber wenn es angereichert ist, hat es eine mittlere Empfindlichkeit. Deuterium liefert normalerweise breite Signale, deren Linienbreite typischerweise zwischen einigen Hertz und einigen Kilohertz variiert. Das Spektrum hat den gleichen engen chemischen Verschiebungsbereich wie bei 1H, aber seine geringe Auflösung und geringere Empfindlichkeit machen es zu einer schlechten Alternative. Deuterium-Deuterium-Kopplungen sind etwa 40-mal kleiner als Proton-Proton-Kopplungen und werden daher nicht beobachtet. In teilweise deuterierten Molekülen können jedoch kleine Proton-Deuterium-Kopplungen beobachtet werden. Die Hauptverwendung von Deuteriumspektren ist die Bestimmung der Effektivität der chemischen Deuterierung (Abb. 4).
Abb. 4. 1H- und 2H-NMR-Spektren von Amphetaminsulfat-d3, die die erfolgreiche spezifische Deuterierung des Methyls zeigen
Eigenschaften von 2H
(Für Erklärung hier klicken)
| Eigenschaft | Wert |
|---|---|
| Spin | 1 |
| Natürliche Häufigkeit | 0.0155% |
| Chemischer Verschiebungsbereich | 13 ppm, von -1 bis 12 |
| Frequenzverhältnis (Ξ) | 15.350609% |
| Referenzverbindung | TMS-d12 pur = 0 ppm |
| Linienbreite der Referenz | 1.7 Hz |
| T1 der Referenz | 1 s |
| Rezeptivität rel. zu 1H bei natürlicher Häufigkeit | 1,50 × 10-6 |
| Rezeptivität rel. zu 1H bei Anreicherung | 9.65 × 10-3 |
| Empfindlichkeit rel. für 13C bei natürlicher Häufigkeit | 8,78 × 10-3 |
| Empfindlichkeit rel. für 13C bei Anreicherung | 56.7 |
| Linienbreitenparameter | 0,41 fm4 |
3Tritium NMR
3T ist der einzige Kern, der empfindlicher ist als Proton (1H). Da es sich um ein Spin-½-Isotop des Wasserstoffs handelt, sehen die Spektren von vollständig tritiierten Verbindungen ähnlich aus wie die von 1H, mit effektiv denselben chemischen Verschiebungen, aber mit etwas höherer Empfindlichkeit, Dispersion und Kopplungskonstanten. Allerdings ist 3T sehr radioaktiv, so dass die meisten NMR-Studien mit teilweise und spezifisch markierten Verbindungen durchgeführt werden.
Unser Labor verfügt nicht über die Ausrüstung, um Tritium zu handhaben oder Tritium-NMR-Spektren zu erfassen. Wir sind jedoch bereit, die Logistik zu besprechen, wenn es eine Nachfrage für diesen Service gibt.
Eigenschaften von 3H
(Hier klicken für Erklärung)
| Eigenschaft | Wert |
|---|---|
| Spin | ½ |
| Natürliche Häufigkeit | 0.0000000000000003% |
| Chemischer Verschiebungsbereich | 13 ppm, von -1 bis 12 |
| Frequenzverhältnis (Ξ) | 106.663974% |
| Referenzverbindung | TMS-t1 < 1% in CDCl3 = 0 ppm |
| Linienstärke der Referenz | ~0.1 Hz |
| T1 der Referenz | ~20 s |
| Rezeptivität rel. zu 1H bei natürlicher Häufigkeit | 4 × 10-18 |
| Rezeptivität rel. für 1H bei Anreicherung | 1,21 |
| Empfindlichkeit rel. für 13C bei natürlicher Häufigkeit | 2 × 10-14 |
| Empfindlichkeit rel. für 13C bei Anreicherung | 7103 |
Sicherheitshinweis:
Einige der hier genannten Stoffe sind sehr gefährlich. Fragen Sie einen qualifizierten Chemiker um Rat, bevor Sie mit ihnen umgehen. Qualifizierte Chemiker sollten die einschlägige Sicherheitsliteratur prüfen, bevor sie mit unbekannten Substanzen umgehen oder Ratschläge geben. NMR-Lösungsmittel sind giftig und die meisten sind brennbar. Insbesondere TMS ist giftig, flüchtig und brennbar: Tragen Sie Schutzhandschuhe und arbeiten Sie in einer Haube. Alle deuterierten Verbindungen sind giftig. Tritium ist radioaktiv: Vergewissern Sie sich vor dem Umgang damit, dass Sie über die notwendige Sachkenntnis und Ausrüstung verfügen.