Warum binden sich Atome aneinander?
Atome binden sich aneinander, damit sie ihre Energie senken und stabil werden können. Und wenn sich Atome mit anderen Atomen verbinden, bilden sie oft Moleküle mit einzigartigen chemischen und physikalischen Eigenschaften. Lassen Sie uns das folgende Modell verwenden, um zu erklären, wie sich Atome verbinden, um stabil zu werden.
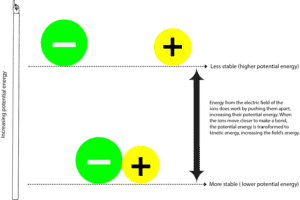
Wenn das negativ geladene Atom (Anion) und das positiv geladene Atom (Kation) eine Verbindung eingehen, sind sie in der Regel stabiler mit geringerer potentieller Energie. Die potentielle Energie ist die Energie aufgrund der relativen Positionen dieser Ionen in dem sie umgebenden elektrischen Feld. Ein elektrisches Feld ist ein Bereich, in dem eine Kraft ausgeübt wird. In gewisser Weise ist ein elektrisches Feld ähnlich wie ein magnetisches Feld. Und diese Kraftlinien, die einen Magneten umgeben, kann man sehen, wenn man Eisenfeilspäne um ihn herum ausbreitet.
Um das negative Ion vom positiven Ion zu trennen, muss das elektrische Feld, das die Ionen umgibt, Arbeit leisten, indem es diese Ionen auseinander zieht. Während das elektrische Feld dies tut, überträgt es auch Energie auf diese Teilchen und erhöht ihre potentielle Energie. Sie können diesen Prozess damit vergleichen, dass Sie zwei Magnete anziehen, die sich zueinander hingezogen fühlen. In diesem Fall sind Sie das Kraftfeld, das die Energie liefert, um sie auseinander zu ziehen, und während Sie sie auseinander ziehen, erhöhen die Magnete ihre potenzielle Energie. Und weil sie mehr Arbeit verrichten müssen, um sich voneinander fernzuhalten, werden sie instabil. Sobald Sie loslassen, werden die beiden Magnete schnell zueinander hingezogen, wodurch ihre potentielle Energie sinkt. Nun,
Wo ist der Rest der potentiellen Energie hin?
Diese Energie wurde in Form von kinetischer Energie an Sie und die Umgebung zurückgegeben. Kinetische Energie ist die Energie, die ein Objekt hat, wenn es sich bewegt, und wir fühlen diese Energie oft als Wärme. Jedes Mal, wenn Sie also Wärme spüren, bedeutet das, dass sich Energie von einem heißeren Ort zu einem kälteren Ort bewegt. Oder anders ausgedrückt, von einer stärker konzentrierten zu einer weniger konzentrierten Quelle. Denken Sie daran, dass Energie niemals andersherum übertragen werden kann – von einem kälteren zu einem heißeren Ort.
Wenn also Energie vom und zurück zum Feld oder vom und zurück zum Universum übertragen wird, sagen wir normalerweise, dass Energie erhalten bleibt. Das heißt, wir können keine Energie erzeugen oder zerstören, wir können sie nur von einer Form in eine andere umwandeln. Das ist von potentieller zu kinetischer Energie und von kinetischer zu potentieller Energie.
Was benutzen Atome, um sich mit anderen Atomen zu verbinden?
Atome benutzen ihre Valenzelektronen, um sich mit anderen Atomen zu verbinden. Und damit Atome eine Bindung eingehen können, müssen sie mindestens eines der folgenden Dinge tun;
- Elektronen von anderen Atomen gewinnen
- Elektronen an andere Atome verlieren
- Elektronen mit anderen Atomen teilen
Und erinnere dich daran, dass Valenzelektronen das höchste Energieorbital in einem Atom besetzen. Und Sie können diese Elektronen visualisieren, wenn Sie die Elektronenkonfiguration für ein Atom schreiben. Wenn Sie das mit den Hauptgruppenelementen der ersten und zweiten Periode tun, werden Sie feststellen, dass Wasserstoff ein Valenzelektron hat, Stickstoff 5, Sauerstoff 6 und Neon 8.
Wenn wir diese Valenzelektronen zeichnen, indem wir Punkt(e) auf die obere, rechte, untere und linke Seite ihrer chemischen Symbole setzen, erhalten wir diese einfachen Diagramme, die Lewis-Punktdiagramme genannt werden, benannt zu Ehren von Lewis, der sie als erster benutzte, um die Idee der Bindung zu erklären. Lassen Sie uns nun die Bindung anhand der folgenden Lewis-Strukturen weiter diskutieren:
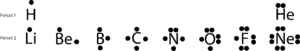
Wenn Sie sich die Elemente der zweiten Periode ansehen, werden Sie feststellen, dass nur Neon (Ne) zwei Elektronen auf jeder seiner vier Seiten hat. Wenn Sie alle Elektronen auf allen vier Seiten zusammenzählen, werden Sie feststellen, dass es von acht Elektronen umgeben ist.
Die Zahl acht ist an die letzte Ziffer der Gruppennummer gebunden, zu der Ne gehört, Gruppe 18. Diese spezielle Gruppe von Elementen, die sogenannten Edelgase, sind unter normalen Bedingungen stabil und nicht reaktiv. Mit Ausnahme von Helium haben sie alle acht Valenzelektronen in der Gruppe.
Aus ihrem chemischen Verhalten konnte Lewis ableiten, dass die anderen Elemente, um eine stabile Konfiguration wie die Edelgase zu erreichen, mit anderen Atomen reagieren müssen, um diese zu erreichen. Aus dieser Schlussfolgerung schlug Lewis die Oktettregel vor. Die Achtregel.
Aber es gibt Ausnahmen, wie man sieht, braucht Wasserstoff nur zwei Elektronen, um eine stabile Konfiguration ähnlich wie He zu erreichen. Trotz dieser und anderer Unzulänglichkeiten können Lewis-Punktstrukturen auf einfache Weise erklären, wie Atome binden, ohne dass wir komplexe Atomorbitale zeichnen müssen.
Was veranlasst Atome, sich mit anderen Atomen zu verbinden?
Energie! Energie ist normalerweise die treibende Kraft hinter einer Bindung. Damit Atome eine Bindung eingehen können, müssen sie ein empfindliches Gleichgewicht zwischen den anziehenden und abstoßenden Kräften ihrer Kerne und Elektronen herstellen. Um zu erfahren, wie zwei Wasserstoffatome Elektronen teilen, um das Wasserstoffmolekül zu bilden, klicken Sie hier.