
Schlüsselwörter:
amorph,kristall
Glas auf molekularer Ebene
Wenn wir über Polymere sprechen, reden wir ab und zu über Glas, vor allem, wenn es um Verbundwerkstoffe geht. Glasfasern werden oft zur Verstärkung von Polymeren verwendet. Aber was ist dieses Zeug namens Glas? Wir verwenden es natürlich oft in Verbindung mit Polymeren, aber ist Glas selbst ein Polymer?
Bevor wir diese Frage angehen, lassen Sie uns einen Blick darauf werfen, was Glas ist. Das hochwertigste Glas hat die chemische Formel SiO2. Aber das ist irreführend. Bei dieser Formel denkt man an kleine Siliziumdioxid-Moleküle, analog zu den Kohlendioxid-Molekülen. Aber kleine Siliziumdioxid-Moleküle gibt es nicht.

 Stattdessen kommt SiO2 in der Natur oft als kristalliner Feststoff vor, mit einer Struktur, wie Sie sie rechts sehen. Jedes Siliziumatom ist an vier Sauerstoffatome gebunden, natürlich tetraedrisch; und jedes Sauerstoffatom ist an zwei Siliziumatome gebunden. Wenn SiO2 in dieser kristallinen Form vorliegt, nennen wir es Kieselsäure. Sie haben schon einmal Kieselsäure gesehen. Wenn Sie große, riesige Kristalle davon finden, nennen wir es Quarz. Wenn wir viele kleine, winzige Kristalle davon haben, nennen wir es Sand.
Stattdessen kommt SiO2 in der Natur oft als kristalliner Feststoff vor, mit einer Struktur, wie Sie sie rechts sehen. Jedes Siliziumatom ist an vier Sauerstoffatome gebunden, natürlich tetraedrisch; und jedes Sauerstoffatom ist an zwei Siliziumatome gebunden. Wenn SiO2 in dieser kristallinen Form vorliegt, nennen wir es Kieselsäure. Sie haben schon einmal Kieselsäure gesehen. Wenn Sie große, riesige Kristalle davon finden, nennen wir es Quarz. Wenn wir viele kleine, winzige Kristalle davon haben, nennen wir es Sand.
Aber diese Kieselsäure ist kein Glas. Wir müssen erst etwas damit machen, damit es zu Glas wird. Wir müssen es erhitzen, bis es schmilzt, und es dann sehr schnell abkühlen. Wenn es schmilzt, brechen die Silizium- und Sauerstoffatome aus ihrer Kristallstruktur heraus. Wenn wir es langsam abkühlen würden, würden sich die Atome langsam wieder in ihrer kristallinen Anordnung anordnen, während sie langsamer werden. (Denken Sie daran, dass Wärme eigentlich nur die zufällige Bewegung von Atomen und Molekülen ist. Heiße Atome bewegen sich viel, kalte Atome bewegen sich sehr wenig.)
Wenn wir es aber schnell genug abkühlen, werden die Atome der Kieselsäure sozusagen in ihren Spuren gestoppt. Sie werden keine Zeit haben, sich aufzustellen, und sie werden in irgendeiner alten Anordnung feststecken. Sie sehen dann etwa so aus:v
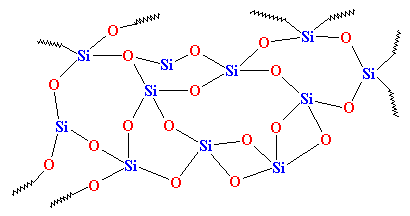
Wie Sie sehen können, gibt es keine Ordnung in der Anordnung der Atome. Wir nennen solche Materialien amorph. Das ist das Glas, das für Teleskoplinsen und solche Dinge verwendet wird. Es hat sehr gute optische Eigenschaften, aber es ist spröde. Für alltägliche Anwendungen brauchen wir etwas Zäheres. Das meiste Glas wird aus Sand hergestellt, und wenn wir den Sand einschmelzen, fügen wir normalerweise etwas Natriumcarbonat hinzu. Dadurch erhalten wir ein härteres Glas mit einer Struktur, die wie folgt aussieht:
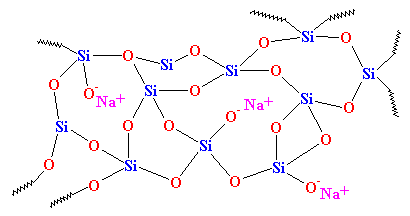
Dies ist das Glas, das Sie jeden Tag in Gläsern und Fenstern sehen, und es ist das Glas, das in Verbundwerkstoffen verwendet wird. In der Tat wurde es früher „Sodaglas“ genannt, um es von Quarz zu unterscheiden.
Ist das nun ein Polymer oder nicht? Normalerweise wird es nicht als solches betrachtet. Warum eigentlich? Manche sagen, es sei anorganisch, und Polymere sind normalerweise organisch. Aber es gibt viele anorganische Polymere. Was ist zum Beispiel mit Polysiloxanen? Diese linearen, und ja, anorganischen Materialien haben eine Struktur, die der von Glas sehr ähnlich ist, und sie werden als Polymere betrachtet. Werfen Sie einen Blick auf ein Polysiloxan:
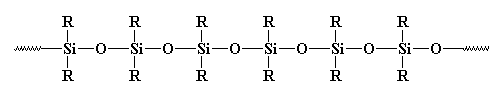
Was ist mit der Vernetzung?
In gewissem Sinne könnte man Glas als ein hoch vernetztes Polysiloxan betrachten. Aber normalerweise denken wir nicht so darüber. Warum eigentlich nicht? Wahrscheinlich, weil man selbst in einem hoch vernetzten System noch eine Polymerkette verfolgen und sehen könnte, wo die Vernetzungen sind. Aber bei Glas wäre es schwierig, das zu tun.
Hier ist ein Vergleich, der diesen Punkt verdeutlicht: Kohlenstofffasern und Kohlenstoff-Nanoröhren. Um die Familie zu vervollständigen, kommt noch etwas Diamant hinzu. „Welche Familie?“, fragen Sie. Einfach die des Kohlenstoffs, der an andere Kohlenstoffe in einer zwei- oder dreidimensionalen Anordnung gebunden ist, und NICHT an irgendetwas anderes gebunden ist. Reiner Kohlenstoff!
Warum ist vollständig vernetzter Kohlenstoff kein Polymer?
Erinnern Sie sich nun daran, dass Kohlenstoff wirklich an vier andere Atome gebunden sein will. Normalerweise sind das vier verschiedene andere Atome, aber Mehrfachbindungen an das gleiche Atom zählen auch. Das ist der Punkt, an dem die meisten Vinylmonomere ins Spiel kommen: Sie haben eine Kohlenstoff-Kohlenstoff-Doppelbindung, was bedeutet, dass jeder Kohlenstoff im Vinyl nur an zwei andere Atome neben dem Kohlenstoff am anderen Ende der Doppelbindung gebunden sein kann: vier Bindungen insgesamt.
Nun zum interessanten Teil. In Graphen, Kohlenstofffasern und Kohlenstoff-Nanoröhren sind die Kohlenstoffe NUR an andere Kohlenstoffatome gebunden. In diesen Verbindungen hat jedoch jeder Kohlenstoff eine Kombination aus Doppel- und Einfachbindungen, was zu einer stark delokalisierten Menge von Molekülorbits führt. Das bedeutet, dass diese Materialien Elektronen leiten und sie sind elektrisch leitfähig. Interessantes Experiment: Legen Sie ein Bündel Kohlenstofffasern in eine Mikrowelle und zappen Sie: Flamme und Rauch, da die Elektronen, die sich im Material bewegen, mit Sauerstoff reagieren und in Rauch aufgehen!
Diamant ist sogar noch interessanter, da es das härteste bekannte Material ist. Warum ist er so hart und trotzdem transparent und kann das Licht so schön brechen? Es ist ja nur reiner Kohlenstoff, aber mit einem Haken: Jeder Kohlenstoff hat nun vier Einfachbindungen zu vier anderen Kohlenstoffatomen. Diese perfekt symmetrische Anordnung von Kohlenstoffen hat eine perfekte Anordnung von Bindungen, die in vier verschiedene Richtungen gehen. „Besser geht es nicht“, werden Sie vielleicht sagen.
Hält man diese reinen Kohlenstoffnetzwerke also für Polymere? Nein, und zwar aus demselben Grund, aus dem es Glas nicht ist. Es läuft alles auf Konvention und Geschichte hinaus. Seitdem wir herausgefunden haben, wie ein organisches Polymer aussieht, passten Glas und Diamant einfach nicht dazu. Ein Vorurteil, wenn Sie so wollen, da sie die Anforderung eines vollständig vernetzten Polymers erfüllen. Oh, nun, andere Schlachten zu schlagen…
 |
Zurück zum Level Drei Verzeichnis |
 |
Zurück zum Macrogalleria-Verzeichnis |