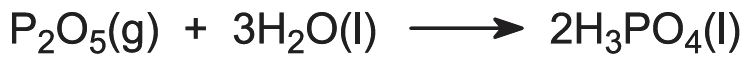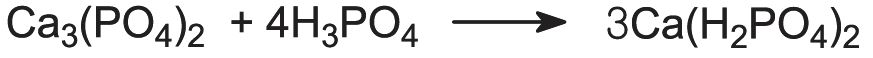Verwendung von Phosphorsäure
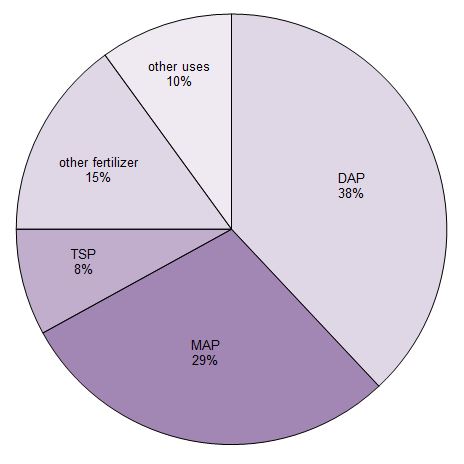
Ungefähr 90 % der produzierten Phosphorsäure wird zur Herstellung von Düngemitteln verwendet. Sie wird hauptsächlich in drei Phosphatsalze umgewandelt, die als Düngemittel verwendet werden. Das sind Triple-Superphosphat (TSP), Diamoniumhydrogenphosphat (DAP) und Monoammoniumdihydrogenphosphat (MAP).
Abbildung 1 Verwendungen von Phosphorsäure.
Daten von Potash Corporation, 2014
Phosphate werden auch auf vielfältige andere Weise verwendet, u. a. in Erfrischungsgetränken und als Zusatz im Futter für Rinder, Schweine und Geflügel.
Obwohl ihre Verwendung als Builder in Waschmitteln in vielen Ländern ausläuft, ist dies in einigen Ländern immer noch eine wichtige Verwendung für die Säure.
Jahresproduktion von Phosphorsäure
| Welt | 43 Millionen Tonnen1,2,3 |
| China | 17 Millionen Tonnen4 |
| Südost- und Nord-Ostasien (einschließlich Indonesien und Japan) |
10 Mio. Tonnen4 |
| USA | 8.4 Millionen Tonnen5 |
1 Potash Corporation, 2014
2 JDCPhosphate, 2014
3 Schätzung für 2016
4 Hochgerechnet aus Daten, IHS,Markit, 2015
5 2015 Business of Chemistry, American Chemistry Council, 2016
Herstellung von Phosphorsäure
Phosphorsäure wird durch zwei Verfahren hergestellt:
a) das ’nasse‘ Verfahren
b) das thermische Verfahren
Das thermische Verfahren erzeugt normalerweise ein konzentrierteres und reineres Produkt, ist aber energieintensiv (wegen der Herstellung des Phosphors selbst). Die durch den „nassen“ Weg hergestellte Säure ist weniger rein, wird aber bei der Herstellung von Düngemitteln verwendet.
(a) Nassverfahren
Phosphorsäure wird aus Fluorapatit, bekannt als Phosphatgestein, 3Ca3(PO4)2.CaF2, durch Zugabe von konzentrierter (93 %) Schwefelsäure in einer Reihe von gut gerührten Reaktoren hergestellt. Dabei entstehen Phosphorsäure und Calciumsulfat (Gips) sowie andere unlösliche Verunreinigungen. Wasser wird zugegeben und der Gips wird zusammen mit anderen unlöslichen Stoffen (z. B. Kieselsäure) durch Filtration entfernt. Das Fluorid, als H2SiF6, wird in einem weiteren Schritt durch Verdampfung entfernt.
Obwohl die Reaktion stufenweise unter Beteiligung von Calciumdihydrogenphosphat abläuft, kann die Gesamtreaktion wie folgt dargestellt werden:
Es kommt jedoch zu Nebenreaktionen, z. B. mit im Gestein vorhandenem Calciumfluorid und Calciumcarbonat:


Ein wichtiges Nebenprodukt dabei und bei der Herstellung von Fluorwasserstoff ist die Fluorkieselsäure. Sie kann mit Natriumhydroxid neutralisiert werden, um Natriumhexafluorosilikat zu bilden. Die Säure wird auch zur Herstellung von Aluminiumfluorid verwendet, das wiederum bei der Herstellung von Aluminium zum Einsatz kommt.
Die Kristallstruktur des gebildeten Calciumsulfats hängt von den Reaktionsbedingungen ab. Bei 340-350 K ist das Hauptprodukt das Dihydrat, CaSO4.2H2O. Bei 360-380 K entsteht das Halbhydrat, CaSO4.1/2H2O.
Calciumsulfat wird abfiltriert und die Säure anschließend durch Vakuumdestillation auf ca. 56 % P2O5 aufkonzentriert.
Das Produkt aus der „Nassprozess“-Säure ist unrein, kann aber ohne weitere Reinigung zur Düngemittelherstellung verwendet werden (siehe unten). Alternativ kann sie weiter auf ca. 70 % P2O5 eingedampft werden, eine Lösung, die Superphosphorsäure genannt wird und direkt als flüssiges Düngemittel verwendet wird.
Um industrielle Phosphate herzustellen, wird die Säure durch Lösungsmittelextraktion gereinigt, z. B. mit Methylisobutylketon (MIBK), in dem die Säure leicht löslich ist, und auf 60 % P2O5-Gehalt konzentriert. Diese Säure kann weiter mit Lösungsmitteln gereinigt werden, um sie von Schwermetallen zu befreien, und entfluoriert werden (durch Verdampfen), um ein Produkt in Lebensmittelqualität zu erhalten.
(b) Thermischer Prozess
Die Rohstoffe für diesen Prozess sind Phosphor und Luft:
Zunächst wird Phosphor in den Ofen gesprüht und an der Luft bei etwa 1800-3000 K verbrannt.
Die meisten Prozesse verwenden ungetrocknete Luft und viele beinhalten die Zugabe von Dampf zum Phosphorbrenner, um einen Film aus kondensierten Polyphosphorsäuren zu erzeugen und aufrechtzuerhalten, der den Brennerturm aus Edelstahl (extern wassergekühlt) schützt. Die Produkte aus dem Brennerturm gelangen direkt in einen Hydrationsturm, wo das gasförmige Phosphoroxid in recycelter Phosphorsäure absorbiert wird:
Alternativ kann der Phosphor in getrockneter Luft verbrannt werden. Das Phosphorpentoxid wird als weißes Pulver kondensiert und separat zu Phosphorsäure hydratisiert.
Bei dieser Methode kann die Wärme zurückgewonnen und wiederverwendet werden.
Bei der Verbrennung und der direkten Hydratation, wie zuvor beschrieben, entstehen hochkorrosive Bedingungen. Die Anlagen sind aus rostfreiem Stahl gebaut oder mit Kohlenstoffsteinen ausgekleidet. Um die Korrosion zu verringern, werden die Wände der Brenner- und Hydratortürme gekühlt, aber die Reaktorprodukte treten bei einer Temperatur aus, die für eine nützliche Wärmerückgewinnung zu niedrig ist.
Das Produkt Säure hat eine Konzentration von ca. 85 %.
Tetraphosphorsäure, eine aus einer Familie von Polyphosphorsäuren, die selektiv hergestellt werden kann, wird entweder durch Abkochen von Wasser bei hohen Temperaturen in einem Kohlenstoffgefäß oder durch Zugabe von festem Phosphorpentoxid zu fast siedender Phosphorsäure hergestellt. Die erste Methode ergibt wegen des hohen Arsengehalts von Phosphorpentoxid meist das reinere Produkt.
Phosphate
Die Salze der Phosphorsäure, die Phosphate, sind die Verbindungen, die in der Landwirtschaft, der Industrie und im Haushalt weit verbreitet sind.
(a) Ammoniumphosphate
Monoammoniumdihydrogenphosphat und Diammoniumhydrogenphosphat werden viel als Düngemittel verwendet und werden durch Mischen des richtigen Verhältnisses von Phosphorsäure mit wasserfreiem Ammoniak in einer rotierenden Trommel hergestellt.
Die Wahl des zu verwendenden Ammoniumphosphats hängt vom Verhältnis von Stickstoff und Phosphor ab, das für die Kulturpflanze benötigt wird.
(b) Calciumphosphate
Die Calciumphosphate werden in großem Umfang als Düngemittel verwendet. Calciumdihydrogenphosphat, Ca(H2PO4)2, wird durch die Reaktion von Phosphatgestein mit Schwefelsäure hergestellt:
Dieses ist als Superphosphat bekannt. Es enthält ca. 20 % P2O5.
Wenn Phosphatgestein mit Phosphorsäure statt mit Schwefelsäure behandelt wird, entsteht eine konzentriertere Form von Calciumdihydrogenphosphat mit einem insgesamt höheren P2O5-Gehalt (50 %):
Dieses ist als Dreifach-Superphosphat bekannt. Der höhere Phosphatgehalt wird dadurch erreicht, dass das Produkt nicht mehr mit Calciumsulfat verdünnt wird.
(c) Natriumphosphate
Natriumphosphate werden durch Reaktion von Phosphorsäure und einer konzentrierten Lösung von Natriumhydroxid im entsprechenden (stöchiometrischen) Verhältnis hergestellt. Das Produkt kristallisiert aus.
- Mononatriumdihydrogenphosphat (MSP, NaH2PO4) wird in Metallreinigungs- und Oberflächenvorbereitungsformulierungen, als Phosphatquelle in der pharmazeutischen Herstellung und als pH-Kontrollmittel in Zahnpasten, in der glasartigen Emaillierung (Sanitärkeramik) und bei der Herstellung von Stärkephosphaten verwendet. Eine der größten Verwendungen ist die Aufbereitung von Trinkwasser. Entweder Phosphorsäure oder MSP können verwendet werden, um eine dünne unlösliche Schicht aus Bleiphosphat auf Bleirohren zu erzeugen, um die Auflösung des Bleis durch die Säuren im Wasser zu verhindern.
- Dinatriumhydrogenphosphat (Na2HPO4) wird als Weichmacher in Schmelzkäse, in Emaillen und Keramikglasuren, in der Ledergerbung, in der Farbstoffherstellung und als Korrosionsschutzmittel in der Wasseraufbereitung verwendet.
- Trinatriumphosphat (Na3PO4) wird in Hochleistungsreinigern verwendet, z. B. beim Entfetten von Stahl. Es ist ein Alkali und ein Sequestriermittel für Kalziumionen, das diese in Lösung hält und die Bildung von Schaum verhindert.
- Dinatriumpyrophosphat (Na2H2P2O7) wird als Backtriebmittel in Brot/Kuchen (es unterstützt die Freisetzung von Kohlendioxid aus Backpulver), als Eisenoxid-Unterdrücker (Verdunkelungs- oder Bräunungseffekt) bei der Herstellung verschiedener Lebensmittel und als Dispergiermittel in Bohrschlamm für Ölbohrungen verwendet.