Was ist der Elektronenspin?
Der Elektronenspin ist eine Quanteneigenschaft der Elektronen, eine Form des Drehimpulses, dessen Größe permanent ist.Wie Ladung und Ruhemasse ist der Spin eine fundamentale, unveränderliche Eigenschaft des Elektrons.

Als Lehrmethode wird der Elektronenspin manchmal mit der Drehung der Erde um ihre eigene Achse alle 24 Stunden verglichen.Wenn sich das Elektron im Uhrzeigersinn um seine Achse dreht, spricht man von Spin-up, gegen den Uhrzeigersinn von Spin-down – eine bequeme, wenn auch mathematisch nicht ganz begründbare Erklärung.
Der mit dem Elektronenspin verbundene Drehimpuls ist unabhängig vom Bahndrehimpuls, der mit der Reise des Elektrons um den Kern verbunden ist.
Der Elektronenspin wird nicht zur Definition von Elektronenschalen, Unterschalen oder Orbitalen verwendet, im Gegensatz zu den Quantenzahlen n, l und ml.
Elektronenspin vs. Elektronenspin-Quantenzahl
Elektronenspin und die Elektronenspin-Quantenzahl werden oft als ein und dasselbe behandelt.Beides sind Quantenzahlen.Sie sind in Wirklichkeit unterschiedliche, aber sehr eng verwandte Konzepte.
– der Elektronenspin hat das Symbol s
– die Elektronenspin-Quantenzahl hat das Symbol ms.
s
Der Elektronenspin, s, hat nur einen möglichen Wert, nämlich ½. Wie die Ruhemasse und die Ladung des Elektrons variiert der Spin nicht.
ms
Im Gegensatz zu Masse und Ladung des Elektrons hat der Spin eine Orientierung, die durch die Spinquantenzahl ms angegeben wird.
ms kann positiv oder negativ sein.
Unterschiedliche Möglichkeiten, ms auszudrücken, sind zu schreiben:
– + oder –
– spin-up oder spin-down
–  oder
oder 
Im folgenden Diagramm befindet sich Helium beispielsweise im Elektronen-Grundzustand.
Eines seiner Elektronen hat den Spin-up, das andere den Spin-down. Oder eines seiner Elektronen hat einen positiven Spin, das andere einen negativen.
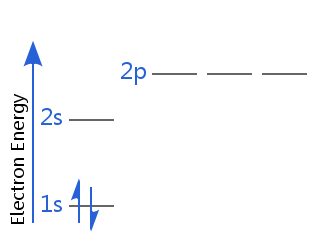
Es ist üblich zu sagen, dass jedes Elektron in einem Atom vollständig durch vier Quantenzahlen charakterisiert ist:
– n: die Hauptquantenzahl
– l: die Bahndrehimpuls-Quantenzahl
– ml: die magnetische Quantenzahl
– ms: die Spin-Quantenzahl
Wir nehmen s nicht auf, weil sein Wert nicht variiert. Er ist immer halb so groß. Der Wert der Spinquantenzahl ms wird also allgemein als ±½ geschrieben.
Die Entdeckung des Elektronenspins
Der eingebaute oder intrinsische Spin des Elektrons wurde erstmals 1922 von Otto Stern und Walther Gerlach entdeckt, aber in Erwin Schrödingers Wellengleichung von 1926 nicht berücksichtigt.
Wolfgang Pauli führte den Elektronenspin erfolgreich als Zusatz in die Wellenmechanik ein.Drei Quantenzahlen waren bereits in Gebrauch; Paulis Einführung des Spins vervollständigte das Quantenbild des Elektrons in einem Wasserstoffatom.
Paul Diracs berühmte relativistische Gleichung für das Elektron, die Dirac-Gleichung, brachte 1928 den Elektronenspin als natürliche Folge der Quantenphysik hervor: Der Spin war kein Zusatz mehr.
