Lernziele
Am Ende dieses Abschnitts werden Sie in der Lage sein:
- Symbolisieren Sie die Zusammensetzung von Molekülen mit Hilfe von Molekülformeln und empirischen Formeln
- Darstellen Sie die Bindungsanordnung von Atomen in Molekülen mit Hilfe von Strukturformeln
Eine Molekülformel ist eine Darstellung eines Moleküls, die chemische Symbole verwendet, um die Arten von Atomen anzuzeigen, gefolgt von tiefgestellten Indizes, um die Anzahl der Atome jeder Art im Molekül anzuzeigen. (Ein tiefgestelltes Zeichen wird nur verwendet, wenn mehr als ein Atom eines bestimmten Typs vorhanden ist.) Molekülformeln werden auch als Abkürzungen für die Namen von Verbindungen verwendet.
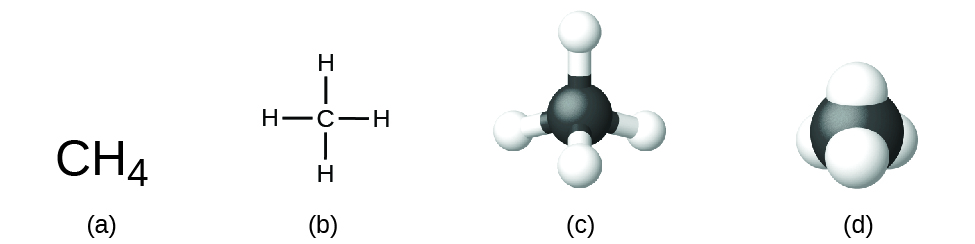
Die Strukturformel für eine Verbindung gibt die gleichen Informationen wie die Molekülformel (die Arten und Anzahl der Atome im Molekül), zeigt aber auch, wie die Atome im Molekül verbunden sind. Die Strukturformel für Methan enthält Symbole für ein C-Atom und vier H-Atome und gibt damit die Anzahl der Atome im Molekül an (Abbildung 1). Die Linien stellen Bindungen dar, die die Atome zusammenhalten. (Eine chemische Bindung ist eine Anziehungskraft zwischen Atomen oder Ionen, die sie in einem Molekül oder einem Kristall zusammenhält.) Wir werden später über chemische Bindungen sprechen und sehen, wie man die Anordnung der Atome in einem Molekül vorhersagen kann. Für den Moment genügt es zu wissen, dass die Linien ein Hinweis darauf sind, wie die Atome in einem Molekül miteinander verbunden sind. Ein Kugel-Stab-Modell zeigt die geometrische Anordnung der Atome mit nicht maßstabsgetreuen Atomgrößen, und ein raumfüllendes Modell zeigt die relativen Größen der Atome.
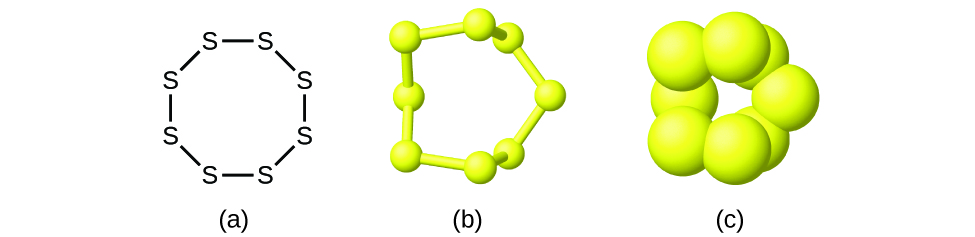
Obwohl viele Elemente aus diskreten, einzelnen Atomen bestehen, existieren einige als Moleküle, die aus zwei oder mehr Atomen des Elements bestehen, die chemisch miteinander verbunden sind. Zum Beispiel bestehen die meisten Proben der Elemente Wasserstoff, Sauerstoff und Stickstoff aus Molekülen, die jeweils zwei Atome enthalten (sogenannte zweiatomige Moleküle) und daher die Molekularformeln H2, O2 bzw. N2 haben. Andere Elemente, die häufig als zweiatomige Moleküle vorkommen, sind Fluor (F2), Chlor (Cl2), Brom (Br2) und Iod (I2). Die häufigste Form des Elements Schwefel besteht aus Molekülen, die aus acht Schwefelatomen bestehen; seine Summenformel lautet S8 (Abbildung 2).
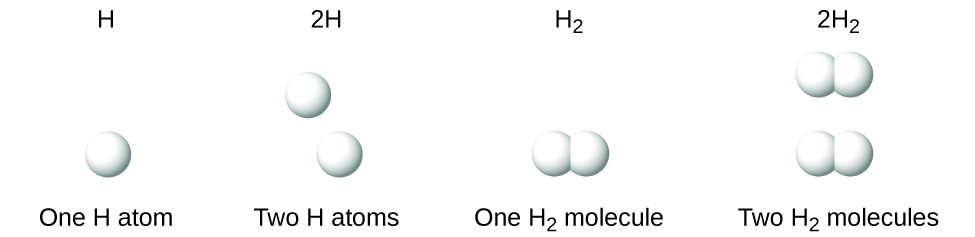
Es ist wichtig zu beachten, dass ein tiefgestellter Index nach einem Symbol und eine Zahl vor einem Symbol nicht dasselbe bedeuten; zum Beispiel stehen H2 und 2H für deutlich unterschiedliche Arten. H2 ist eine Molekülformel; sie steht für ein zweiatomiges Wasserstoffmolekül, das aus zwei Atomen des Elements besteht, die chemisch aneinander gebunden sind. Der Ausdruck 2H hingegen steht für zwei separate Wasserstoffatome, die nicht zu einer Einheit verbunden sind. Der Ausdruck 2H2 steht für zwei Moleküle zweiatomigen Wasserstoffs (Abbildung 3).
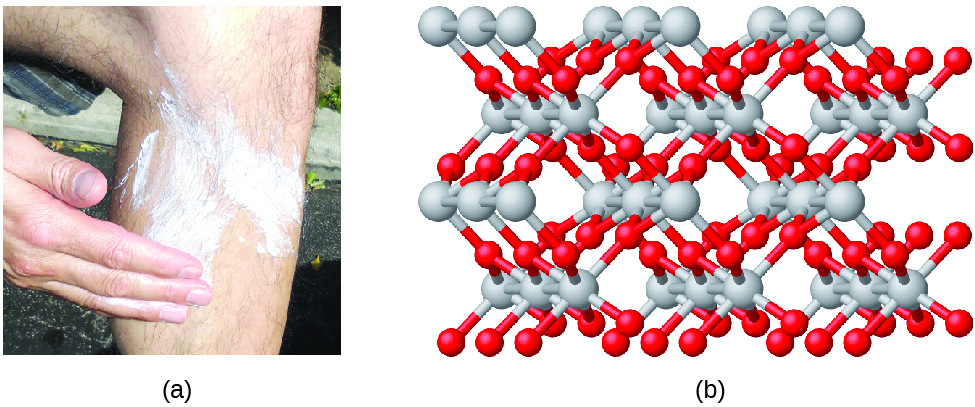
Verbindungen werden gebildet, wenn sich zwei oder mehr Elemente chemisch verbinden und dabei Bindungen entstehen. Zum Beispiel können Wasserstoff und Sauerstoff zu Wasser und Natrium und Chlor zu Kochsalz reagieren. Wir beschreiben die Zusammensetzung dieser Verbindungen manchmal mit einer empirischen Formel, die die Arten der vorhandenen Atome und das einfachste ganzzahlige Verhältnis der Anzahl der Atome (oder Ionen) in der Verbindung angibt. Zum Beispiel hat Titandioxid (das als Pigment in weißer Farbe und in der dicken, weißen, blockierenden Art von Sonnenschutzmitteln verwendet wird) die empirische Formel TiO2. Diese identifiziert die Elemente Titan (Ti) und Sauerstoff (O) als Bestandteile von Titandioxid und zeigt an, dass doppelt so viele Atome des Elements Sauerstoff wie Atome des Elements Titan vorhanden sind (Abbildung 4).
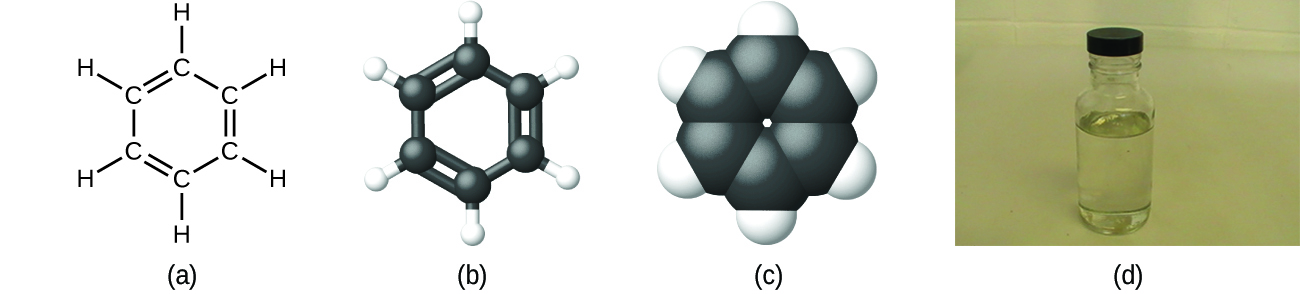
Wie bereits erwähnt, können wir eine Verbindung mit einer Summenformel beschreiben, in der die tiefgestellten Buchstaben die tatsächliche Anzahl der Atome jedes Elements in einem Molekül der Verbindung angeben. In vielen Fällen wird die Summenformel einer Substanz aus der experimentellen Bestimmung sowohl der empirischen Formel als auch der Molekülmasse (der Summe der Atommassen aller Atome, aus denen das Molekül besteht) abgeleitet. So kann z. B. experimentell bestimmt werden, dass Benzol zwei Elemente enthält, nämlich Kohlenstoff (C) und Wasserstoff (H), und dass für jedes Kohlenstoffatom im Benzol ein Wasserstoffatom vorhanden ist. Die Summenformel lautet also CH. Eine experimentelle Bestimmung der Molekülmasse zeigt, dass ein Molekül Benzol sechs Kohlenstoffatome und sechs Wasserstoffatome enthält, so dass die Summenformel für Benzol C6H6 lautet (Abbildung 5).
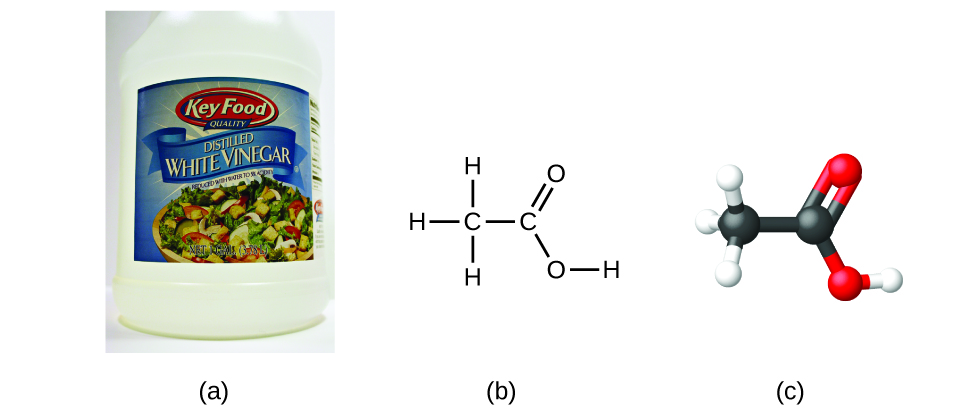
Wenn wir die Formel einer Verbindung kennen, können wir leicht die Summenformel bestimmen. (Dies ist eher eine akademische Übung; in der Praxis wird in der Regel die umgekehrte Reihenfolge eingehalten). Zum Beispiel lautet die Summenformel für Essigsäure, die Komponente, die dem Essig seinen scharfen Geschmack verleiht, C2H4O2. Diese Formel besagt, dass ein Molekül Essigsäure (Abbildung 6) zwei Kohlenstoffatome, vier Wasserstoffatome und zwei Sauerstoffatome enthält. Das Verhältnis der Atome ist 2:4:2. Dividiert man durch den kleinsten gemeinsamen Nenner (2), erhält man das einfachste, ganzzahlige Verhältnis der Atome, nämlich 1:2:1, so dass die Summenformel CH2O lautet. Beachten Sie, dass eine Summenformel immer ein ganzzahliges Vielfaches einer Summenformel ist.
Beispiel 1
Empirische und molekulare Formeln
Moleküle von Glucose (Blutzucker) enthalten 6 Kohlenstoffatome, 12 Wasserstoffatome und 6 Sauerstoffatome. Wie lauten die molekulare und die empirische Formel von Glucose?
Lösung
Die molekulare Formel lautet C6H12O6, weil ein Molekül tatsächlich 6 C-, 12 H- und 6 O-Atome enthält. Das einfachste ganzzahlige Verhältnis von C- zu H- zu O-Atomen in Glucose ist 1:2:1, also lautet die Summenformel CH2O.
Kontrollieren Sie Ihr Wissen
Ein Molekül Metaldehyd (ein Pestizid, das gegen Schnecken und Nacktschnecken eingesetzt wird) enthält 8 Kohlenstoffatome, 16 Wasserstoffatome und 4 Sauerstoffatome. Wie lauten die molekulare und die empirische Formel von Metaldehyd?
Antwort:
Molekulare Formel, C8H16O4; empirische Formel, C2H4O

Mit einer Online-Simulation können Sie den Aufbau von Molekülen erkunden.
Lee Cronin
Was ist es, was Chemiker tun? Laut Lee Cronin (Abbildung 7) stellen Chemiker sehr komplizierte Moleküle her, indem sie kleine Moleküle „zerhacken“ und sie „zurückbauen“. Er fragt sich, ob wir „einen wirklich coolen universellen Chemiesatz“ herstellen könnten, indem wir die Chemie „app-ing“ nennen. Könnten wir die Chemie „app-en“?
In einem TED-Vortrag aus dem Jahr 2012 beschreibt Lee eine faszinierende Möglichkeit: die Kombination einer Sammlung chemischer „Tinten“ mit einem 3D-Drucker, der in der Lage ist, eine Reaktionsapparatur (winzige Reagenzgläser, Bechergläser und dergleichen) herzustellen, um einen „universellen Chemie-Baukasten“ zu schaffen. Dieses Toolkit könnte dazu verwendet werden, maßgeschneiderte Medikamente zur Bekämpfung eines neuen Superbugs herzustellen oder Medizin zu „drucken“, die persönlich auf Ihre genetische Veranlagung, Ihre Umgebung und Ihre gesundheitliche Situation abgestimmt ist. Cronin: „Was Apple für die Musik getan hat, würde ich gerne für die Entdeckung und Verteilung von verschreibungspflichtigen Medikamenten tun.“ Sehen Sie sich seinen vollständigen Vortrag auf der TED-Website an.

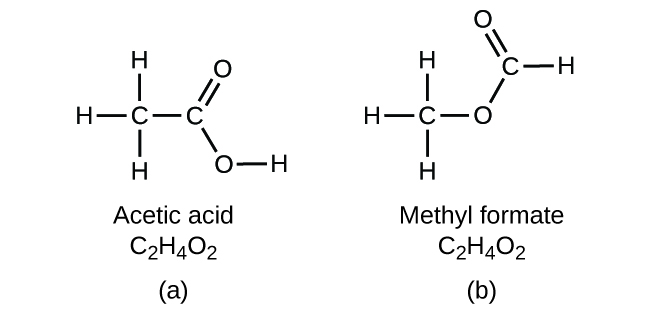
Es ist wichtig, sich bewusst zu machen, dass es möglich ist, dass die gleichen Atome auf unterschiedliche Weise angeordnet sind: Verbindungen mit der gleichen Summenformel können unterschiedliche Atom-zu-Atom-Bindungen und damit unterschiedliche Strukturen haben. Könnte es zum Beispiel eine andere Verbindung mit der gleichen Formel wie Essigsäure, C2H4O2, geben? Und wenn ja, wie wäre die Struktur ihrer Moleküle?
Wenn Sie vorhersagen, dass eine weitere Verbindung mit der Formel C2H4O2 existieren könnte, dann haben Sie gutes chemisches Verständnis bewiesen und liegen richtig. Zwei C-Atome, vier H-Atome und zwei O-Atome können auch zu einem Methylformiat angeordnet werden, das in der Industrie, als Insektizid und für schnelltrocknende Lacke verwendet wird. Methylformiatmoleküle haben eines der Sauerstoffatome zwischen den beiden Kohlenstoffatomen, was sich von der Anordnung in Essigsäuremolekülen unterscheidet. Essigsäure und Methylformiat sind Beispiele für Isomere – Verbindungen mit der gleichen chemischen Formel, aber unterschiedlichen Molekülstrukturen (Abbildung 8). Beachten Sie, dass dieser kleine Unterschied in der Anordnung der Atome eine große Auswirkung auf ihre jeweiligen chemischen Eigenschaften hat. Sie würden sicherlich nicht eine Lösung von Methylformiat als Ersatz für eine Lösung von Essigsäure (Essig) verwenden wollen, wenn Sie Salatdressing herstellen.
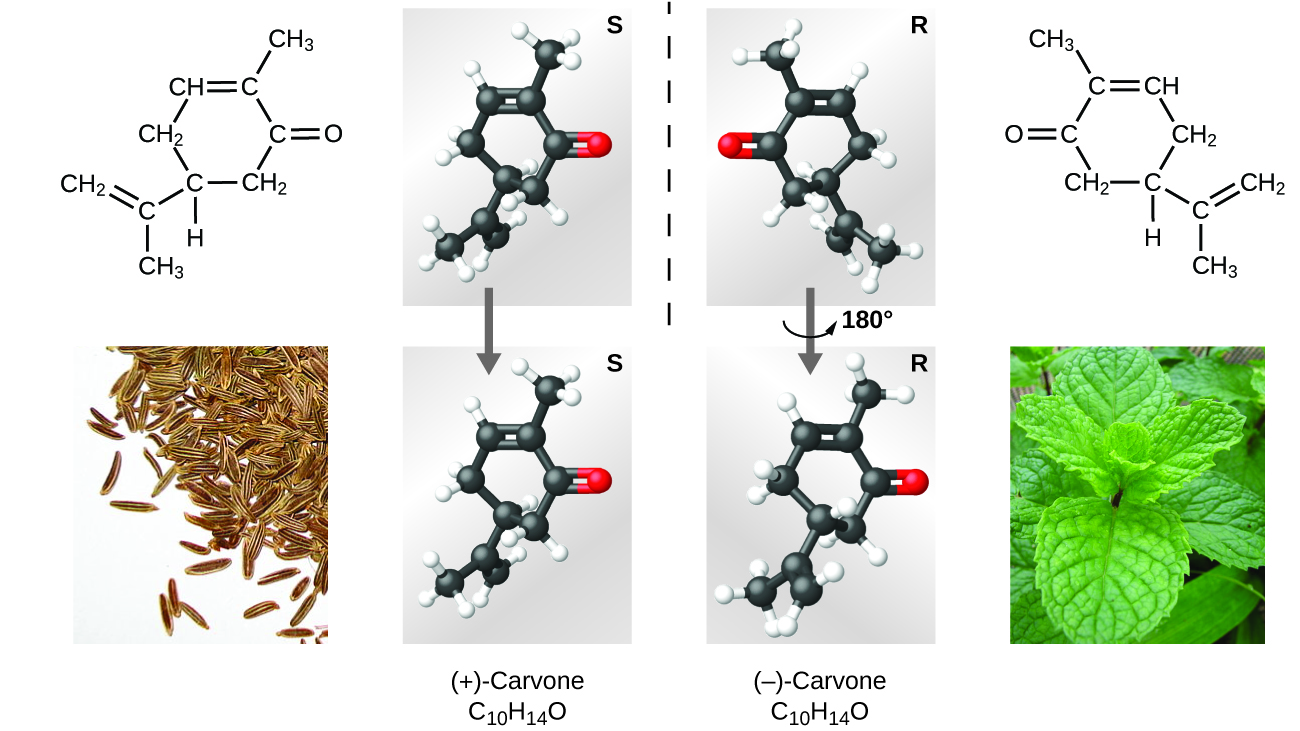
Es gibt viele Arten von Isomeren (Abbildung 9). Essigsäure und Methylformiat sind Strukturisomere, also Verbindungen, bei denen sich die Moleküle darin unterscheiden, wie die Atome miteinander verbunden sind. Es gibt auch verschiedene Arten von räumlichen Isomeren, bei denen die relativen Orientierungen der Atome im Raum unterschiedlich sein können. Zum Beispiel besteht die Verbindung Carvon (zu finden in Kümmel, Minze und Mandarinenschalen) aus zwei Isomeren, die spiegelbildlich zueinander sind. S-(+)-Carvon riecht nach Kümmel, und R-(-)-Carvon riecht nach Minze.

Wählen Sie diesen Link, um eine Erklärung der Isomere zu sehen, räumliche Isomere und warum sie unterschiedlich riechen (wählen Sie das Video mit dem Titel „Mirror Molecule: Carvone“).
Eine Summenformel verwendet chemische Symbole und tiefgestellte Indizes, um die genaue Anzahl der verschiedenen Atome in einem Molekül oder einer Verbindung anzugeben. Eine empirische Formel gibt das einfachste, ganzzahlige Verhältnis der Atome in einer Verbindung an. Eine Strukturformel gibt die Bindungsanordnung der Atome im Molekül an. Kugel-Stab-Modelle und raumfüllende Modelle zeigen die geometrische Anordnung der Atome in einem Molekül. Isomere sind Verbindungen mit der gleichen Summenformel, aber unterschiedlicher Anordnung der Atome.
Chemie – Übungen am Ende des Kapitels
- Erkläre, warum sich das Symbol für ein Atom des Elements Sauerstoff und die Formel für ein Molekül Sauerstoff unterscheiden.
- Erkläre, warum sich das Symbol für das Element Schwefel und die Formel für ein Molekül Schwefel unterscheiden.
- Schreiben Sie die molekularen und empirischen Formeln der folgenden Verbindungen:
(a)
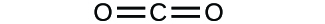
(b)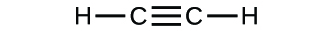
(c)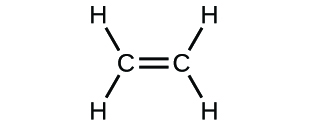
(d)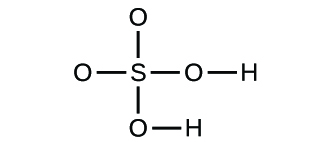
- Schreiben Sie die molekularen und empirischen Formeln der folgenden Verbindungen:
(a)
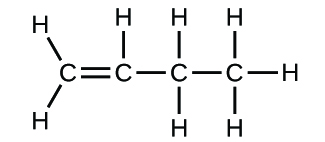
(b)
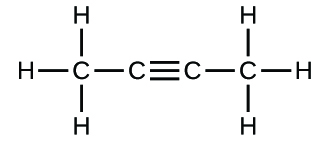
(c)
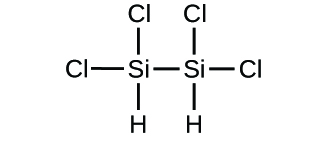
(d)
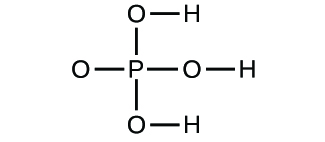
- Bestimmen Sie die Summenformeln für die folgenden Verbindungen:
(a) Koffein, C8H10N4O2
(b) Fructose, C12H22O11
(c) Wasserstoffperoxid, H2O2
(d) Glucose, C6H12O6
(e) Ascorbinsäure (Vitamin C), C6H8O6
- Bestimmen Sie die Summenformeln für die folgenden Verbindungen:
(a) Essigsäure, C2H4O2
(b) Zitronensäure, C6H8O7
(c) Hydrazin, N2H4
(d) Nikotin, C10H14N2
(e) Butan, C4H10
- Schreiben Sie die Summenformeln für die folgenden Verbindungen:
(a)
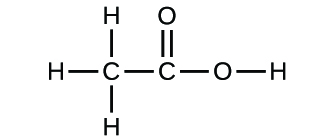
(b)
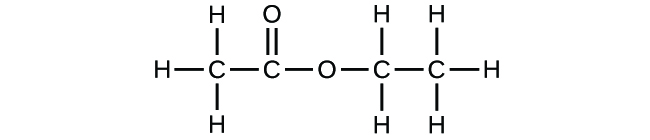
- Öffnen Sie die Simulation „Build a Molecule“ und wählen Sie den Reiter „Larger Molecules“. Wählen Sie einen geeigneten Atom-„Bausatz“, um ein Molekül mit zwei Kohlenstoff- und sechs Wasserstoffatomen zu bauen. Ziehen Sie Atome in den Bereich über dem „Kit“, um ein Molekül zu erstellen. Ein Name wird angezeigt, wenn Sie ein tatsächlich existierendes Molekül erstellt haben (auch wenn es nicht das gewünschte ist). Sie können das Scherenwerkzeug verwenden, um Atome zu trennen, wenn Sie die Verbindungen ändern möchten. Klicken Sie auf „3D“, um das Molekül zu sehen, und sehen Sie sich die Möglichkeiten der Raumfüllung und der Kugel an.
(a) Zeichnen Sie die Strukturformel dieses Moleküls und geben Sie seinen Namen an.
(b) Können Sie diese Atome auf eine beliebige Weise anordnen, um eine andere Verbindung herzustellen?
- Wiederholen Sie mit der Simulation „Build a Molecule“ die Chemie-Übung 8 vom Ende des Kapitels, aber bauen Sie ein Molekül mit zwei Kohlenstoffen, sechs Wasserstoffen und einem Sauerstoff.
(a) Zeichnen Sie die Strukturformel dieses Moleküls und geben Sie seinen Namen an.
(b) Können Sie diese Atome so anordnen, dass ein anderes Molekül entsteht? Wenn ja, zeichne dessen Strukturformel und nenne dessen Namen.
(c) Inwiefern sind die in (a) und (b) gezeichneten Moleküle gleich? Wie unterscheiden sie sich? Wie heißen sie (die Art der Beziehung zwischen diesen Molekülen, nicht ihre Namen).
- Wiederholen Sie mit der Simulation „Ein Molekül bauen“ die Chemie-Übung 8 vom Ende des Kapitels, aber bauen Sie ein Molekül mit drei Kohlenstoffen, sieben Wasserstoffen und einem Chlor.
(a) Zeichnen Sie die Strukturformel dieses Moleküls und geben Sie seinen Namen an.
(b) Können Sie diese Atome so anordnen, dass ein anderes Molekül entsteht? Wenn ja, zeichne dessen Strukturformel und nenne dessen Namen.
(c) Inwiefern sind die in (a) und (b) gezeichneten Moleküle gleich? Wie unterscheiden sie sich? Wie heißen sie (die Art der Beziehung zwischen diesen Molekülen, nicht ihre Namen)?
Glossar
empirische Formel Formel, die die Zusammensetzung einer Verbindung als einfachstes ganzzahliges Verhältnis der Atome angibt Isomere Verbindungen mit der gleichen chemischen Formel, aber unterschiedlichen Strukturen molekulare Formel Formel, die die Zusammensetzung eines Moleküls einer Verbindung angibt und die tatsächliche Anzahl der Atome jedes Elements in einem Molekül der Verbindung angibt. räumliche Isomere Verbindungen, bei denen sich die relativen Orientierungen der Atome im Raum unterscheiden Strukturformel zeigt die Atome in einem Molekül und wie sie miteinander verbunden sind Strukturisomer eine von zwei Substanzen, die die gleiche Summenformel, aber unterschiedliche physikalische und chemische Eigenschaften haben, weil ihre Atome unterschiedlich gebunden sind
Lösungen
Antworten zu den Übungen zum Chemie-Kapitelende
1. Das Symbol für das Element Sauerstoff, O, steht sowohl für das Element als auch für ein Sauerstoffatom. Ein Sauerstoffmolekül, O2, enthält zwei Sauerstoffatome; der tiefgestellte Index 2 in der Formel muss verwendet werden, um das zweiatomige Molekül von zwei einzelnen Sauerstoffatomen zu unterscheiden.
3. (a) molekulares CO2, empirisches CO2; (b) molekulares C2H2, empirisches CH; (c) molekulares C2H4, empirisches CH2; (d) molekulares H2SO4, empirisches H2SO4
5. (a) C4H5N2O; (b) C12H22O11; (c) HO; (d) CH2O; (e) C3H4O3
7. (a) CH2O; (b) C2H4O
9. (a) Ethanol
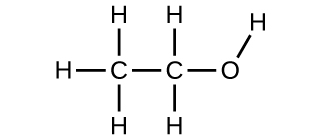
(b) Methoxymethan, besser bekannt als Dimethylether
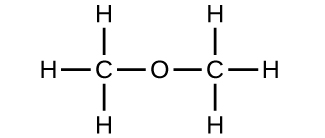
(c) Diese Moleküle haben die gleiche chemische Zusammensetzung (Arten und Anzahl der Atome), aber unterschiedliche chemische Strukturen. Sie sind strukturelle Isomere.
- Lee Cronin, „Print Your Own Medicine,“ Talk presented at TED Global 2012, Edinburgh, Schottland, June 2012. ↵