Lernziele
- Bestimmen Sie die Empfindlichkeit verschiedener Bakterienarten gegenüber verschiedenen Antibiotika und synthetischen Wirkstoffen.
Ein echtes Antibiotikum ist eine antimikrobielle Chemikalie, die von Mikroorganismen gegen andere Mikroorganismen produziert wird. Die Menschheit hat sich diese antimikrobiellen Mittel im Kampf gegen Infektionskrankheiten sehr zunutze gemacht. Viele Medikamente sind heute vollständig synthetisch oder der natürliche Wirkstoff wird manipuliert, um seine Struktur etwas zu verändern, letzteres nennt man Semisynthetika. Bakterien reagieren auf unterschiedliche Weise auf Antibiotika und chemosynthetische Medikamente, sogar innerhalb derselben Spezies. Ein Beispiel: Staphylococcus aureus ist ein häufiges Bakterium der Normalflora, das im Körper vorkommt. Wenn man dieses Bakterium von 5 verschiedenen Menschen isolieren würde, wären die 5 Isolate wahrscheinlich verschiedene Stämme, d.h. leicht genetisch unterschiedlich. Es ist auch wahrscheinlich, dass, wenn Antibiotika-Empfindlichkeitstests mit diesen Isolaten durchgeführt würden, die Ergebnisse gegen die verschiedenen verwendeten Antibiotika variieren würden.
Der Kirby-Bauer-Test für Antibiotika-Empfindlichkeit (auch Diskusdiffusionstest genannt) ist ein Standard, der seit Jahren verwendet wird. Er wurde in den 1950er Jahren entwickelt, von W. Kirby und A. Bauer verfeinert und 1961 von der Weltgesundheitsorganisation standardisiert. Er wurde in klinischen Labors durch automatisierte Tests ersetzt. Dennoch wird der K-B-Test in einigen Labors immer noch verwendet, oder er wird bei bestimmten Bakterien eingesetzt, bei denen die Automatisierung nicht gut funktioniert. Dieser Test wird verwendet, um die Resistenz oder Empfindlichkeit von Aerobiern oder fakultativen Anaerobiern gegenüber bestimmten Chemikalien zu bestimmen, die dann vom Kliniker für die Behandlung von Patienten mit bakteriellen Infektionen verwendet werden können. Das Vorhandensein oder Fehlen eines hemmenden Bereichs um die Scheibe identifiziert die bakterielle Empfindlichkeit gegenüber dem Medikament (Abbildung \(\PageIndex{1}\)).
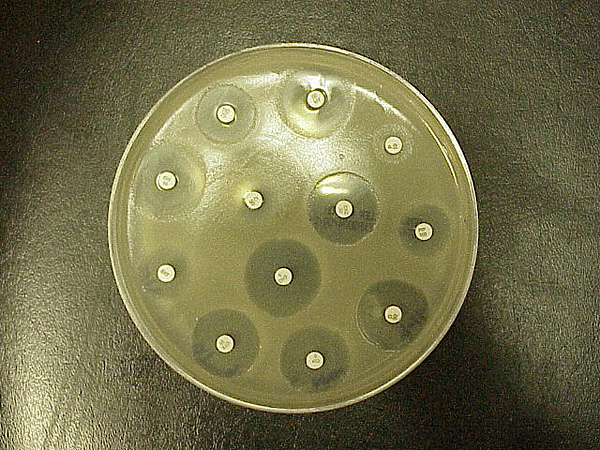
Die Grundlagen sind einfach: Das Bakterium wird auf den Agar getupft und die Antibiotika-Scheiben werden darauf gelegt. Das Antibiotikum diffundiert von der Scheibe in den Agar in abnehmender Menge, je weiter es von der Scheibe entfernt ist. Wenn der Organismus durch die Konzentration des Antibiotikums abgetötet oder gehemmt wird, gibt es KEIN Wachstum im unmittelbaren Bereich um die Scheibe: Dies nennt man die Hemmzone (Abbildung 9.1). Die Zonengrößen werden in einem standardisierten Diagramm nachgeschlagen, um ein Ergebnis von empfindlich, resistent oder intermediär zu erhalten. Viele Diagramme haben eine entsprechende Spalte, die auch die MHK (minimale Hemmkonzentration) für dieses Medikament angibt. Die MHK ist derzeit der Standardtest für Antibiotika-Empfindlichkeitstests, da er mehr relevante Informationen über minimale Dosierungen liefert.
Das Mueller-Hinton-Medium, das für den Kirby-Bauer-Test verwendet wird, ist sehr proteinreich.
Benötigte Materialien: pro Tabelle
- 2 Mueller-Hinton-Agarplatten
- 24 Stunden alte Kulturen (wahrscheinlich Staphylokokken, E. coli, Bacillus subtilus, Enterococcus fecalis) sterile Tupfer
- Antibiotika
- Ethanol
- Zangen
- Pseudomonas aeruginosa Kirby-Bauer-Platte zur Demonstration
- Richtlinientabelle zur Interpretation der Antibiotika-Empfindlichkeit
Die VORGEHEN
2. Abstrichabdeckung ►

- Abstrich einer Mueller-Hinton-Platte mit NUR 2 der Bakterien (in Tabellen werden verschiedene Kombinationen der 4 Bakterien verwendet). Tauchen Sie einen sterilen Tupfer in die Brühe und drücken Sie überschüssige Feuchtigkeit aus, indem Sie den Tupfer gegen die Seite des Röhrchens drücken.
- Tupfen Sie die Oberfläche des Agars vollständig ab (Sie wollen keine unabgetupften Agarbereiche hinterlassen). In den Bildern unten können Sie sehen, was passiert, wenn die Platte nicht korrekt abgetupft wird und das Bakterium gleichmäßig über den gesamten Agar bedeckt wird.
- Nach dem vollständigen Abtupfen der Platte drehen Sie sie um 90 Grad und wiederholen Sie den Abtupfvorgang. (Es ist nicht notwendig, den Tupfer erneut anzufeuchten.) Führen Sie den Tupfer um den Umfang der Platte herum, bevor Sie ihn in den Abwurfbeutel werfen.
- Lassen Sie die Oberfläche etwa 5 Minuten lang trocknen, bevor Sie die antibiotischen Scheiben auf den Agar legen.
- Die Antibiotika-Scheiben:
- Sie verwenden einzelne Antibiotika-Spender.
-
 Sie werden wahrscheinlich eine Pinzette verwenden müssen, um eine Antibiotika-Scheibe aus dem Spender zu entfernen: die Pinzette muss steril sein. Legen Sie die Pinzette in Alkohol, flammen Sie die Pinzette ab, bis sie Feuer fängt, lassen Sie die Flamme erlöschen—-sterile Pinzette.
Sie werden wahrscheinlich eine Pinzette verwenden müssen, um eine Antibiotika-Scheibe aus dem Spender zu entfernen: die Pinzette muss steril sein. Legen Sie die Pinzette in Alkohol, flammen Sie die Pinzette ab, bis sie Feuer fängt, lassen Sie die Flamme erlöschen—-sterile Pinzette. - Berühren Sie jede Scheibe leicht mit Ihrer sterilen Impfschlaufe, um sicherzustellen, dass sie in gutem Kontakt mit der Agaroberfläche ist. Inkubieren Sie kopfüber und inkubieren Sie bei 37o C.
INTERPRETATION
-
 Legen Sie das metrische Lineal quer über die Hemmzone, am breitesten Durchmesser, und messen Sie von einem Rand der Zone zum anderen Rand. Es kann hilfreich sein, die Platte gegen das Licht zu halten.
Legen Sie das metrische Lineal quer über die Hemmzone, am breitesten Durchmesser, und messen Sie von einem Rand der Zone zum anderen Rand. Es kann hilfreich sein, die Platte gegen das Licht zu halten. - Verwenden Sie Millimeter-Maße. Der Scheibendurchmesser ist Teil dieser Zahl.
- Wenn es überhaupt KEINE Zone gibt, geben Sie sie als 0 an – auch wenn die Scheibe selbst etwa 7 mm groß ist.
- Der Zonendurchmesser wird in Millimetern angegeben, in der Tabelle nachgeschlagen und das Ergebnis als empfindlich, resistent oder mittelmäßig angegeben.
- Nehmen Sie die Ergebnisse für Ihre Tabelle sowie für andere Tabellen in die Tabelle auf.
|
Antibiotikum (antimikrobielles Mittel) |
DISC CODE |
Resistent (< oder = mm) |
Intermediär (mm) |
Anfällig (= oder > mm) |
|
|---|---|---|---|---|---|
| Amoxicillin (andere) | AMC | <13 | 14-17 | mm)“ style=“text-ausrichten:Center;“ class=“lt-bio-3483″>>18 | |
| Amoxicillin (Staph) | AMC | 19 | mm)“ style=“text-ausrichten:Mitte;“ class=“lt-bio-3483″>20 | ||
| Ampicillin (andere) | AM | 11 | 12-13 | mm)“ style=“text-ausrichten:Mitte;“ class=“lt-bio-3483″>14 | |
| Ampicillin (Staph) | AM | 28 | mm)“ style=“text-ausrichten:Mitte;“ class=“lt-bio-3483″>29 | ||
| Carbenicillin (Sonstiges) | CB | 17 | 18- | 17 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>23 |
| Carbenicillin (Pseudomonas) | CB | 13 | 14-16 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>17 | |
| Cefoxitin | FOX | 14 | 15-.17 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>18 | |
| Cephalothin | CF | 14 | 15-.17 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>18 | |
| Chloramphenicol | C | 12 | 13-17 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>18 | |
| Ciprofloxacin | CIP-5 | 15 | 16-20 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>21 | |
| Clindamycin | CC-2 | 14 | 15-20 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>21 | |
| Enoxacin (Fluorchinolon, 2. Gen.) | ENX-10 | 14 | 15-17 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>18 | |
| Erthromycin | E | 13 | 14-.22 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>23 | |
| Gentamycin | GM | 12 | 13-.14 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>15 | |
| Kanamycin | K-30 | 13 | 14-17 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>18 | |
| Methicillin (Staph) | M(oderDP) | 9 | 10-13 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>14 | |
| Oxacillin (Staph) | OX | 10 | 11-12 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>13 | |
| Penicillin G (Enterokokken) | P | 14 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>15 | ||
| Penicillin G (Staph) | P | 28 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>29 | ||
| Streptomycin | S-10 | 14 | 15-20 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>21 | |
| Sulfamethoxazol-Trimethoprim | SXT | 10 | 11-15 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>16 | |
| Tetracyclin | Te-…30 | 14 | 15-18 | mm)“ style=“text-align:Mitte;“ class=“lt-bio-3483″>19 | |
| Tobramycin | NN-.10 | 12 | 13-14 | mm)“ style=“text-align:Center;“ class=“lt-bio-3483″>15 | |
| Vancomycin | Va-30 | 9 | 10-11 | mm)“ style=“text-align:center;“ class=“lt-bio-3483″>12 |
TABELLE FÜR ERGEBNISSE
Die Ergebnisse für die 5 Bakterien mit allen Antibiotika aufzeichnen.
Zonendurchmesser in Millimetereinheiten. Verwenden Sie die Tabelle für empfindlich, resistent oder mittelmäßig
FRAGEN
- Je größer die Zonengröße ist, desto mehr ____________ das Bakterium auf dieses Antibiotikum an.
- Welche Maßeinheiten werden zur Messung der Zonengrößen verwendet?
- Wie ist die Empfindlichkeit der Staphylokokken im Vergleich zur Empfindlichkeit der Pseudomonas?
Beitragende
-
Jackie Reynolds, Professorin für Biologie (Richland College)