Einfache kovalente Bindungen
Die einfachste kovalente Bindung wird zwischen zwei Wasserstoffatomen gebildet. Jedes Wasserstoffatom hat ein einzelnes Elektron, und jedes benötigt zwei Elektronen für eine volle Außenschale. Das Wasserstoffmolekül, \(\ce{H_2}\), besteht aus zwei Wasserstoffatomen, die sich ihre beiden Valenzelektronen teilen. Wasserstoff kann auch kovalente Bindungen mit anderen Atomen eingehen. Zum Beispiel benötigen Wasserstoff und Chlor jeweils ein weiteres Elektron, um eine Edelgaskonfiguration zu erreichen. Durch das Teilen von Valenzelektronen (jedes Atom spendet eines) entsteht das stabile \(\ce{HCl}\) Molekül.
Wir werden eine vereinfachte Darstellung von kovalenten Bindungen verwenden, die als Lewis-Strukturen bekannt sind. Diese Zeichnungen sind auch unter verschiedenen anderen Namen bekannt, darunter Lewis-Punktstrukturen oder Elektronenpunktstrukturen. Jeder Punkt in der Struktur repräsentiert ein Valenzelektron in der Verbindung. Zum Beispiel könnte \(\ce{H_2}\) als \(\ce{H} : \ce{H}\) gezeichnet werden. Jeder Punkt stellt ein Valenzelektron dar, und die Tatsache, dass sie zwischen den beiden Atomen platziert sind, bedeutet, dass sie in einer kovalenten Bindung geteilt werden. Bei größeren Molekülen kann es umständlich werden, alle Valenzelektronen einzuzeichnen, daher kann ein Bindungselektronenpaar auch als gerade Linie gezeichnet werden. So kann \(\ce{H_2}\) auch als \(\ce{H-H}\) dargestellt werden.
Wenn wir die Lewis-Struktur von \(\ce{HCl}\) darstellen wollten, würden wir folgendes zeichnen:

Wir können sehen, dass die kovalente Bindung aus zwei Elektronen zwischen dem \(\ce{H}\) und dem \(\ce{Cl}\) besteht. Das \(\ce{H}\) hat eine volle Außenschale mit zwei Elektronen und das Chlor hat eine volle Außenschale mit acht Elektronen. Kovalente Bindungen mit anderen Halogenen können auf die gleiche Weise geschrieben werden.
Ähnliche Arten von Lewis-Strukturen können für andere Moleküle geschrieben werden, die kovalente Bindungen bilden. Viele Verbindungen, die \(\ce{O}\), \(\ce{N}\), \(\ce{C}\), \(\ce{S}\) und \(\ce{P}\) enthalten, werden durch kovalente Bindungen zusammengehalten. Die Anzahl der kovalenten Bindungen, die ein Atom eingehen wird, kann im Allgemeinen durch die Anzahl der Elektronen vorhergesagt werden, die ein Atom benötigt, um seine Valenzschale zu füllen. Zum Beispiel hat Sauerstoff 6 Elektronen in seiner äußeren Schale und benötigt zwei weitere, um diese Schale zu füllen, also wird es nur zwei kovalente Bindungen mit anderen Atomen eingehen. Wenn wir uns das Wassermolekül \(\left( \ce{H_2O} \right)\) (siehe Abbildung unten), sehen wir, dass das Sauerstoffatom insgesamt zwei Bindungen eingeht (eine mit jedem Wasserstoffatom).
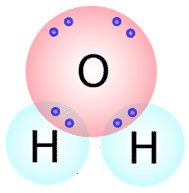
Wie Sie sehen können, gibt es zwei Elektronenpaare, die nicht an einer kovalenten Bindung beteiligt sind. Diese nicht gebundenen Elektronenpaare werden als einsame Paare bezeichnet und tragen zur Gesamtform des Moleküls bei. In ähnlicher Weise benötigt Stickstoff drei Elektronen, um seine Valenzschale zu vervollständigen, so dass er dazu neigt, drei kovalente Bindungen einzugehen, wobei ein einsames Elektronenpaar übrig bleibt.
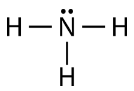
Auch hier steht jede der Linien für ein bindendes Elektronenpaar (eine Einfachbindung), und das einsame Elektronenpaar des Stickstoffs ist als zwei Punkte gezeichnet.