Lernziele
- Die Beziehung zwischen der Konzentration des gelösten Stoffes und den physikalischen Eigenschaften einer Lösung beschreiben.
- Verstehen, dass die Gesamtzahl der nichtflüchtigen gelösten Teilchen die Abnahme des Dampfdrucks, den Anstieg des Siedepunkts und die Abnahme des Gefrierpunkts einer Lösung gegenüber dem reinen Lösungsmittel bestimmt.
Osmotischer Druck ist eine kolligative Eigenschaft von Lösungen, die mit Hilfe einer semipermeablen Membran beobachtet wird, einer Barriere mit Poren, die klein genug sind, um Lösungsmittelmoleküle durchzulassen, nicht aber gelöste Moleküle oder Ionen. Der Nettofluss von Lösungsmittel durch eine semipermeable Membran wird Osmose genannt (vom griechischen osmós, was „stoßen“ bedeutet). Die Richtung des Nettoflusses des Lösungsmittels ist immer von der Seite mit der niedrigeren Konzentration des gelösten Stoffes zu der Seite mit der höheren Konzentration.
Osmose kann mit einem U-Rohr wie in Abbildung \(\PageIndex{1}\) demonstriert werden, das im linken Arm reines Wasser und im rechten Arm eine verdünnte wässrige Glukoselösung enthält. Es findet ein Nettofluss von Wasser durch die Membran statt, bis sich die Pegel in den Armen schließlich nicht mehr ändern, was anzeigt, dass ein Gleichgewicht erreicht wurde. Der osmotische Druck (\(\Pi\)) der Glukoselösung ist die Differenz des Drucks zwischen den beiden Seiten, in diesem Fall den Höhen der beiden Säulen. Obwohl die semipermeable Membran Wassermoleküle in beide Richtungen durchströmen lässt, ist die Durchflussrate nicht in beiden Richtungen gleich, da die Konzentration des Wassers in den beiden Armen nicht gleich ist. Der Nettofluss von Wasser durch die Membran kann verhindert werden, indem ein Druck auf den rechten Arm ausgeübt wird, der dem osmotischen Druck der Glukoselösung entspricht.
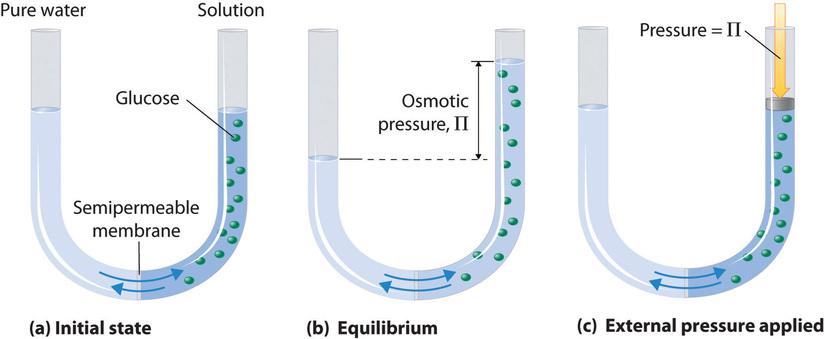
Der osmotische Druck einer Lösung hängt von der Konzentration der gelösten Teilchen ab. Der osmotische Druck gehorcht einem Gesetz, das der idealen Gasgleichung ähnelt:
wobei
- Die Anzahl der Mole des gelösten Stoffes pro Volumeneinheit der Lösung (d.h., die Molarität der Lösung),
- \(R\) ist die ideale Gaskonstante, und
- \(T\) ist die absolute Temperatur.
Wie in Beispiel \(\PageIndex{1}\) gezeigt, neigen osmotische Drücke dazu, ziemlich hoch zu sein, sogar für ziemlich verdünnte Lösungen.
Beispiel \(\PageIndex{1}\): Hefezellen
Wenn sie in eine konzentrierte Salzlösung gegeben werden, sind bestimmte Hefen in der Lage, hohe interne Konzentrationen von Glycerin zu produzieren, um dem osmotischen Druck des umgebenden Mediums entgegenzuwirken. Angenommen, die Hefezellen werden in eine wässrige Lösung mit 4,0 Massenprozent \(NaCl\) gegeben; die Lösungsdichte beträgt 1,02 g/ml bei 25°C.
Berechnen Sie den osmotischen Druck einer 4,0 %igen wässrigen \(NaCl\)-Lösung bei 25°C.
Wenn der normale osmotische Druck im Inneren einer Hefezelle 7,3 atm beträgt, was einer Gesamtkonzentration an gelösten Teilchen von 0,30 M entspricht, welche Konzentration an Glycerin muss die Zelle synthetisieren, um den äußeren osmotischen Druck bei 25°C genau auszugleichen?
Gegeben: Konzentration, Dichte und Temperatur der \(NaCl\)-Lösung; interner osmotischer Druck der Zelle
Gefragt sind: osmotischer Druck der \(NaCl\)-Lösung und die benötigte Konzentration an Glycerin
Strategie:
- Berechnen Sie die Molarität der \(NaCl\)-Lösung mit Hilfe der Formelmasse des gelösten Stoffes und der Dichte der Lösung. Berechnen Sie dann die Gesamtkonzentration der gelösten Teilchen.
- Benutzen Sie Gleichung \ref{eq1}, um den osmotischen Druck der Lösung zu berechnen.
- Subtrahieren Sie den normalen osmotischen Druck der Zellen vom osmotischen Druck der Salzlösung, um den zusätzlichen Druck zu erhalten, der erforderlich ist, um die beiden auszugleichen. Verwenden Sie Gleichung \ref{eq1}, um die Molarität von Glycerin zu berechnen, die zur Erzeugung dieses osmotischen Drucks benötigt wird.
Lösung:
A Die Lösung enthält 4,0 g \(NaCl\) pro 100 g Lösung. Unter Verwendung der Formelmasse von \(NaCl\) (58,44 g/mol) und der Dichte der Lösung (1,02 g/ml) können wir die Molarität berechnen:
&=\left(\dfrac{4.0 \; \cancel{g} \;NaCl}{58.44\; \cancel{g}/mol\; NaCl}\right)\left(\dfrac{1}{100\; \cancel{g \;solution}}\right)\left(\dfrac{1.02\; \cancel{g\; solution}{1.00\; \cancel{mL}\; solution}\right)\left(\dfrac{1000\; \cancel{mL}}{1\; L}\right) \nonumber \\\\&
= 0.70\; M\; NaCl \nonumber \end{align} \nonumber\]
Da 1 Mol \(NaCl\) 2 Mol Teilchen in Lösung erzeugt, ist die Gesamtkonzentration der gelösten Teilchen in der Lösung (2)(0.70 M) = 1,4 M.
B Nun können wir mit Gleichung \ref{eq1} den osmotischen Druck der Lösung berechnen:
&=(1.4 \;mol/L)\left (298\; K) \\\ &= 34 \;atm \end{align*}\]
C Damit die Hefezellen den äußeren osmotischen Druck genau ausgleichen, müssen sie so viel Glycerin produzieren, dass sich ein zusätzlicher innerer Druck von (34 atm – 7,3 atm) = 27 atm ergibt. Glycerin ist ein Nichtelektrolyt, so dass wir Gleichung \ref{eq1} für die diesem osmotischen Druck entsprechende Molarität lösen können:
&= \dfrac{27\; \cancel{atm}}{ (298 \;\cancel{K})} \\ &= 1,1 \;M \;Glycerin \end{align*}\]
Beim Lösen dieser Aufgabe hätten wir auch erkennen können, dass die osmotischen Drücke in den Zellen und in der Lösung nur dann gleich sein können, wenn die Konzentrationen der gelösten Teilchen gleich sind. Es ist gegeben, dass die normale Konzentration an gelösten Teilchen in den Zellen 0,3 M beträgt, und wir haben berechnet, dass die \(NaCl\)-Lösung effektiv 1,4 M an gelösten Teilchen enthält. Die Hefezellen müssen daher genügend Glycerin synthetisieren, um die interne Konzentration an gelösten Teilchen von 0,3 M auf 1,4 M zu erhöhen – also eine zusätzliche Glycerinkonzentration von 1,1 M.
Übung \(\PageIndex{1}\)
Angenommen, die Flüssigkeit im Inneren einer Wurst hat aufgrund des zur Herstellung verwendeten Salzes und Natriumnitrits eine Konzentration an gelösten Teilchen von etwa 0,80 M. Berechnen Sie den osmotischen Druck im Inneren der Wurst bei 100 °C, um zu erfahren, warum erfahrene Köche die halbdurchlässige Haut von Würsten durchstoßen, bevor sie sie kochen.
Antwort: 24 atm
Aufgrund der großen Größenordnung der osmotischen Drücke ist die Osmose in der Biochemie, Biologie und Medizin außerordentlich wichtig. Praktisch jede Barriere, die einen Organismus oder eine Zelle von ihrer Umgebung trennt, verhält sich wie eine semipermeable Membran, die den Fluss von Wasser, aber nicht von gelösten Stoffen zulässt. Das Gleiche gilt für die Kompartimente innerhalb eines Organismus oder einer Zelle. Einige spezialisierte Barrieren, wie die in den Nieren, sind etwas durchlässiger und nutzen einen verwandten Prozess, der Dialyse genannt wird, der sowohl Wasser als auch kleine Moleküle durchlässt, nicht aber große Moleküle wie Proteine.
Das gleiche Prinzip wird seit langem genutzt, um Früchte und ihre wichtigen Vitamine über den langen Winter zu konservieren. Hohe Zuckerkonzentrationen werden in Marmeladen und Gelees nicht nur wegen der Süße verwendet, sondern weil sie den osmotischen Druck stark erhöhen. Auf diese Weise werden alle Bakterien, die beim Kochen nicht abgetötet werden, dehydriert, was sie daran hindert, sich in einem ansonsten reichhaltigen Medium für bakterielles Wachstum zu vermehren. Ein ähnlicher Prozess mit Salz verhindert das Wachstum von Bakterien in Schinken, Speck, gesalzenem Schweinefleisch, gesalzenem Kabeljau und anderen Fleischkonserven. Die Wirkung des osmotischen Drucks wird in Abbildung \(\PageIndex{2}\) dramatisch veranschaulicht, die zeigt, was passiert, wenn rote Blutkörperchen in eine Lösung gegeben werden, deren osmotischer Druck viel niedriger oder viel höher ist als der Innendruck der Zellen.

Zusätzlich zur Kapillarwirkung nutzen Bäume den osmotischen Druck, um Wasser und andere Nährstoffe von den Wurzeln zu den oberen Ästen zu transportieren. Die Verdunstung von Wasser aus den Blättern führt zu einer lokalen Erhöhung der Salzkonzentration, die einen osmotischen Druck erzeugt, der Wasser über den Stamm des Baumes zu den Blättern hinaufzieht.
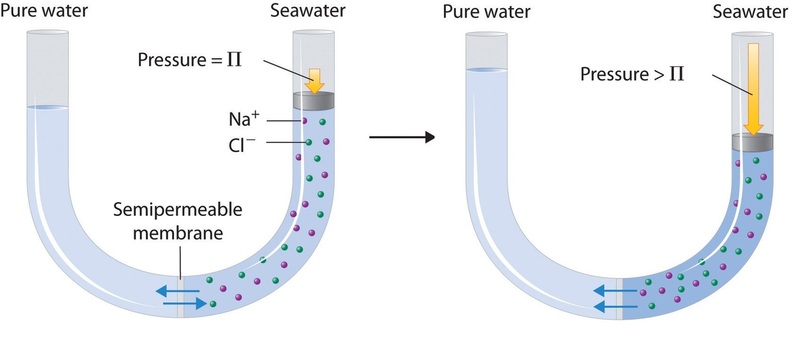
Schließlich kann ein Prozess namens Umkehrosmose genutzt werden, um reines Wasser aus Meerwasser zu gewinnen. Wie in Abbildung \(\PageIndex{3}\) schematisch dargestellt, zwingt die Anwendung von hohem Druck auf Meerwasser die Wassermoleküle dazu, durch eine halbdurchlässige Membran zu fließen, die reines Wasser von der Lösung trennt und das gelöste Salz zurücklässt. Groß angelegte Entsalzungsanlagen, die Hunderttausende von Litern Süßwasser pro Tag produzieren können, sind in den Wüstengebieten des Nahen Ostens üblich, wo sie einen großen Teil des von der Bevölkerung benötigten Süßwassers liefern. Ähnliche Anlagen werden nun auch in Südkalifornien zur Süßwasserversorgung eingesetzt. Kleine, handbetriebene Umkehrosmoseanlagen können etwa 5 l Süßwasser pro Stunde produzieren, genug, um 25 Menschen am Leben zu erhalten, und gehören heute zur Standardausrüstung von Rettungsbooten der US-Marine.
Zusammenfassung
Wenn eine Lösung und ein reines Lösungsmittel durch eine semipermeable Membran getrennt sind, eine Barriere, die Lösungsmittelmoleküle, aber keine gelösten Moleküle durchlässt, ist der Fluss des Lösungsmittels in entgegengesetzte Richtungen ungleich und erzeugt einen osmotischen Druck, der den Druckunterschied zwischen den beiden Seiten der Membran darstellt. Osmose ist der Nettofluss von Lösungsmittel durch eine solche Membran aufgrund unterschiedlicher Lösungsmittelkonzentrationen. Bei der Dialyse wird eine semipermeable Membran mit Poren verwendet, die nur kleine gelöste Moleküle und Lösungsmittelmoleküle durchlassen.